1844試験 試験概要(海外データ)
GS-US-380-1844(1844試験)1-3
1: Molina JM, et al.: Lancet HIV 2018; 5(7): e357.
2: Wohl D, et al.: Patient 2018; 11(5): 561.
3: 社内資料(Phase 3 study : GS-US-380-1844)(承認時評価資料).
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
| 目的 | 抗HIV薬による治療経験があり、ウイルス学的抑制が得られているHIV-1感染症患者を対象として、ドルテグラビル(DTG)およびアバカビル/ラミブジン(ABC/3TC)のレジメン、またはABC/DTG/3TCのFDC注1)からビクテグラビル/エムトリシタビン/テノホビル アラフェナミド(B/F/TAF:ビクタルビ配合錠)へ切り替えた場合の安全性および有効性を評価する。 |
|---|---|
| 対象 | スクリーニング前の連続3ヵ月以上にわたりDTG+ABC/3TCのレジメンまたはABC/DTG/3TCのFDCによってウイルス学的抑制が得られている18歳以上のHIV-1感染症患者で次の条件を満たす563例 いずれかの治験薬に対する耐性が示されていない、eGFRCG注2)が50mL/min以上、慢性B型肝炎なし |
| 試験方法 | 多施設共同無作為化二重盲検実薬対照平行群間非劣性試験(国際共同治験) |
| 投与方法 | 対象患者を以下の2投与群のいずれかに1:1の比率で割り付けた。 ビクタルビ配合錠群:ビクタルビ配合錠(B 50mg/F 200mg/TAF 25mg)およびABC/DTG/3TCのFDCに対応したプラセボを食事に関係なく1日1回経口投与 ABC/DTG/3TC群:ABC/DTG/3TC(ABC 600mg/DTG 50mg/3TC 300mg)のFDCおよびビクタルビ配合錠に対応したプラセボを食事に関係なく1日1回経口投与 |
| 主要評価項目 | FDAのスナップショットアルゴリズムによる投与48週時点の血漿中HIV-1 RNA量が50 copies/mL以上の被験者の割合に基づき、DTG+ABC/3TCのレジメンまたはABC/DTG/3TCのFDCからビクタルビ配合錠に切り替えた場合と、DTG+ABC/3TCをABC/DTG/3TCのFDCとして継続した場合の有効性の比較評価(非劣性) |
| 副次評価項目 | FDAのスナップショットアルゴリズムによる投与48週時点の血漿中HIV-1 RNA量が50 copies/mL未満および20 copies/mL未満の被験者の割合、投与48週時点のCD4細胞数のベースラインからの変化量、投与48週までの2投与群間での安全性および忍容性(有害事象の発現状況、腎機能、脂質・血糖パラメータ)の評価、投与48週までの寛骨(大腿骨近位部)および脊椎の骨密度(BMD)のベースラインからの変化率、ベースライン、投与4週、12週、48週時のPRO〔HIV-SI(HIV症状インデックス)、PSQI(ピッツバーグ睡眠質問票)〕等 |
| 解析計画 | 主要評価項目における実薬対照に対するビクタルビ配合錠の非劣性は、投与群間差(ビクタルビ配合錠群−ABC/DTG/3TC群)の95.002%信頼区間の上限値が、事前に設定した非劣性マージン4%を上回らない場合と定義した。投与群間差およびその95.002%信頼区間は、2つの逆向きの片側検定を用い、条件付けを行わない正確法に基づき算出した。 PRO:HIV-SIにおける症状は2分法でlogistic回帰モデル化され、未調整(共変数なし)、調整済み(ベースライン時の年齢、性別、人種、eGFR、VACS Indexスコア、CD4数、FIB-4 Indexスコア、症状の有無、重篤な精神疾患、HIV-SI symptomカウント、SF-36 PCS、SF-36MCS、HIV-1 RNA量を共変量とする)解析により各時点での治療との関連を推定した。 また、質問票に記入した4時点を通じたHIV-SIの症状パターンを示すために、一般混合効果モデルによる縦断的多変量モデル化を行い、治療と各症状の関連を推定した。PSQIにおける睡眠の質も同様に治療との関連を推定した。 |
注1)固定用量配合錠
注2) Cockcroft-Gault式による推算糸球体ろ過量
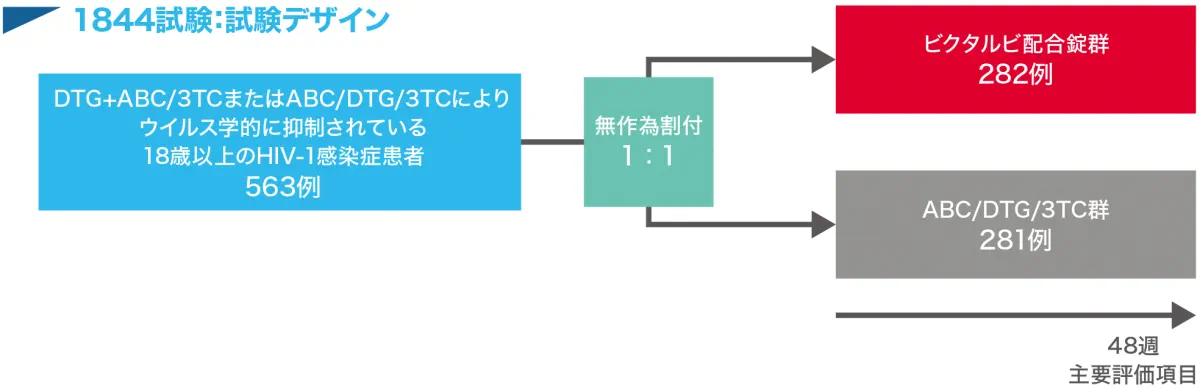
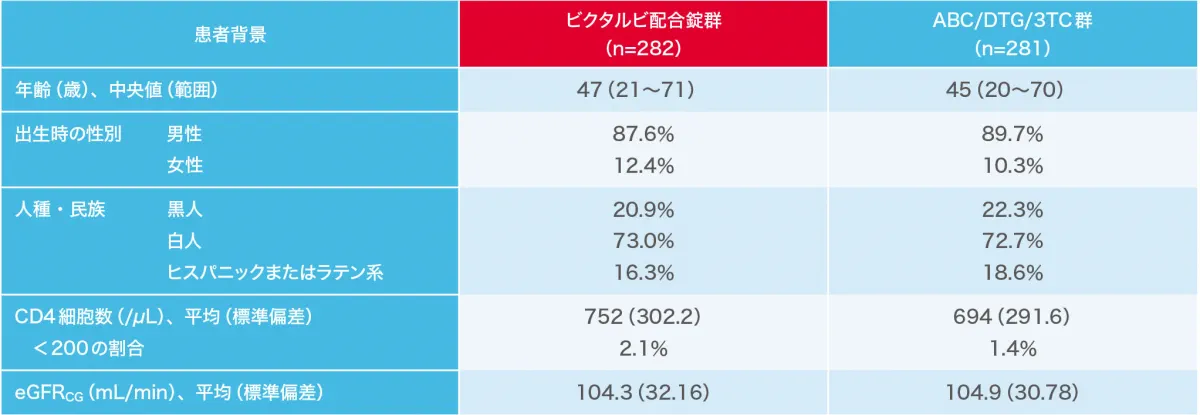
無作為割り付けされ、治験薬を少なくとも1回投与された563例(ビクタルビ配合錠群282例、ABC/DTG/3TCレジメン継続投与群281例)を最大の解析対象集団(FAS)および安全性解析対象集団とした。
1844試験の患者背景