試験概要
試験デザイン
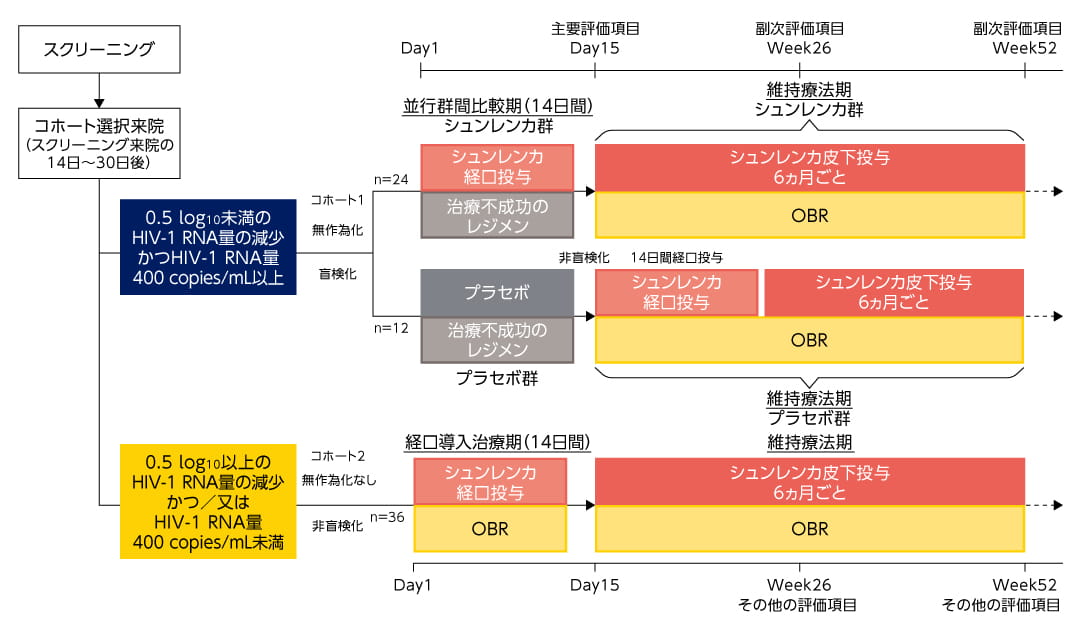
コホート1の組入れが完了した場合又は患者がコホート1の選択基準に合致しなかった場合に、コホート2へ組み入れた。
治験薬を1回以上投与された全患者を有効性解析対象集団(FAS)及び安全性解析対象集団とした。
| 目的 | 多剤治療歴を有する多剤耐性HIV-1感染症患者を対象とし、最適なバックグラウンドレジメン(OBR)とシュンレンカを併用した際の有効性、安全性をプラセボと比較検討する。 |
|---|---|
| 対象 | 多剤治療歴を有する多剤耐性HIV-1感染症患者72例(日本からの組み入れ2例を含む) |
| 主な選択基準 |
|
| 試験方法 | 無作為化、部分盲検、プラセボ対照、多施設共同、並行群間比較 |
| 投与方法 | <コホート1> 14日間の並行群間比較期及び維持療法期から成り、コホート選択来院時(スクリーニング来院14日~30日後)に、スクリーニング来院時と比較して0.5 log10未満のHIV-1 RNA量の減少かつHIV-1 RNA量400 copies/mL以上の適格患者を組み入れ、盲検下で、シュンレンカ14日間経口投与(シュンレンカ群)又はプラセボ14日間経口投与(プラセボ群)のいずれかに2:1で無作為に割付けた。
治療不成功のレジメンの投与を継続するとともに、Day1及びDay2にシュンレンカ600mg(300mg錠×2)を、Day8にシュンレンカ300mg(300mg錠×1)を経口投与した。 プラセボ群: 治療不成功のレジメンの投与を継続するとともに、プラセボ錠を、Day1及びDay2に2錠、Day8に1錠を経口投与した。
Day15よりOBRを開始、Day15及びそれ以降は6ヵ月(26週間)ごとに、シュンレンカ927mg(309mg/mL注射剤1.5mLを2ヵ所)を皮下投与した。 プラセボ群: Day15よりOBRを開始するとともに、Day15及びDay16にシュンレンカ600mg(300mg錠×2)、Day22にシュンレンカ300mg(300mg錠×1)を経口投与した。Day29及びそれ以降は6ヵ月(26週間)ごとにシュンレンカ927mg(309mg/mL注射剤1.5mLを2ヵ所)を皮下投与した。 コホート1の組入れが完了した場合又は患者がコホート1の選択基準に合致しなかった場合は、経口導入治療期及び維持療法期から成るコホート2へ組み入れた。
シュンレンカの経口投与と皮下投与はいずれも食事に関係なく投与された。 |
| 主要評価項目 | 並行群間比較期終了時(Day15)におけるHIV-1 RNA量がベースラインから0.5 log10 copies/mL以上減少した患者の割合(コホート1) |
| 副次評価項目 | FDAスナップショットアルゴリズム*によるWeek26及びWeek52時点のHIV-1 RNA量が50 copies/mL未満及び200 copies/mL未満である患者の割合(コホート1) |
| その他の評価項目 |
|
| 解析計画 | 主要評価項目では、コホート1のシュンレンカ群とプラセボ群の間で、並行群間比較期終了時におけるHIV-1 RNA量がベースラインから0.5 log10 copies/mL以上減少した患者の割合に差がないことを帰無仮説とした。投与群間の比較は、Fisherの正確確率検定を両側有意水準0.05で実施することとした。 事前規定されているサブグループ解析として、Week26及びWeek52時点のHIV-1 RNA量が50 copies/mL未満である患者の割合(コホート1及びコホート2)について、年齢(<50歳、≧50歳)、性別(男性、女性)、ベースラインのCD4細胞数(<200 cells/μL、≧200 cells/μL)、HIV-1 RNA量(≦100,000 copies/mL、>100,000 copies/mL)、OBRに基づく総合感受性スコア(0 to <1、1 to <2、≧2)、INSTI耐性プロファイル(耐性あり、耐性なし)等によって検討した。 |
OBR:最適なバックグラウンドレジメン、INSTI:インテグラーゼ阻害剤、NNRTI:非核酸系逆転写酵素阻害剤、NRTI:核酸系逆転写酵素阻害剤、PI:プロテアーゼ阻害剤、FDA:アメリカ食品医薬品局
a 海外の一部地域のみ b コホート1のみ
* 米国FDAが定義したスナップショットアルゴリズムは、米国FDAガイダンスHuman Immunodeficiency Virus-1 Infection:治療のための抗レトロウイルス薬の開発{U. S. Department of Health and Human Services 2015}に基づくフローチャートに示されています。
患者背景
| コホート1 | コホート2 (n=36) |
全体 (N=72) |
|||
|---|---|---|---|---|---|
| シュンレンカ群 (n=24) |
プラセボ群 (n=12) |
全体 (n=36) |
|||
| 年齢[歳、中央値(範囲)] | 55 (24, 71) |
54 (27, 59) |
54 (24, 71) |
49 (23, 78) |
52 (23, 78) |
| 性別[例数(%)] | |||||
| 男性 | 17 (70.8%) |
9 (75.0%) |
26 (72.2%) |
28 (77.8%) |
54 (75.0%) |
| 女性 | 7 (29.2%) |
3 (25.0%) |
10 (27.8%) |
8 (22.2%) |
18 (25.0%) |
| 人種[例数(%)] | |||||
| 黒人 | 10 (41.7%) |
6 (54.5%) |
16 (45.7%) |
11 (30.6%) |
27 (38.0%) |
| 白人 | 12 (50.0%) |
4 (36.4%) |
16 (45.7%) |
13 (36.1%) |
29 (40.8%) |
| アジア人 | 2 (8.3%) |
1 (9.1%) |
3 (8.6%) |
12 (33.3%) |
15 (21.1%) |
| 非特定 | 0 | 1 | 1 | 0 | 1 |
| BMI[kg/m2、平均値(SD)] | 26.0 (5.38) |
24.8 (4.58) |
25.6 (5.09) |
26.5 (5.76) |
26.1 (5.42) |
| HIV-1 RNA量[log10 copies/mL、平均値(SD)]*1 | 3.97 (0.922) |
4.87 (0.393) |
4.27 (0.890) |
4.07 (1.158) |
4.17 (1.031) |
| HIV-1 RNA量のカテゴリ[例数(%)] | |||||
| ≦100,000 copies/mL | 23 (95.8%) |
6 (50.0%) |
29 (80.6%) |
29 (80.6%) |
58 (80.6%) |
| >100,000 copies/mL | 1 (4.2%) |
6 (50.0%) |
7 (19.4%) |
7 (19.4%) |
14 (19.4%) |
| CD4細胞数[cells/µL、平均値(SD)] | 199 (166.1) |
85 (62.9) |
161 (149.5) |
258 (273.4) |
210 (224.2) |
| CD4細胞数のカテゴリ[例数(%)] | |||||
| <50 cells/µL | 3 (12.5%) |
4 (33.3%) |
7 (19.4%) |
9 (25.0%) |
16 (22.2%) |
| ≧50 cells/µL <200 cells/µL |
13 (54.2%) |
7 (58.3%) |
20 (55.6%) |
10 (27.8%) |
30 (41.7%) |
| ≧200 cells/µL <350 cells/µL |
6 (25.0%) |
1 (8.3%) |
7 (19.4%) |
8 (22.2%) |
15 (20.8%) |
| ≧350 cells/µL <500 cells/µL |
1 (4.2%) |
0 | 1 (2.8%) |
4 (11.1%) |
5 (6.9%) |
| ≧500 cells/µL | 1 (4.2%) |
0 | 1 (2.8%) |
5 (13.9%) |
6 (8.3%) |
| CD4の割合[%、平均値(SD)] | 10.8% (7.77) |
5.9% (4.12) |
9.2% (7.11) |
11.5% (8.62) |
10.3% (7.93) |
| 前治療で使用したARV薬の数[中央値(範囲)] | 9 (2, 24) |
9 (3, 22) |
9 (2, 24) |
13 (3, 25) |
11 (2, 25) |
| 主要なクラスで2剤以上に耐性を示した患者[例数(%)] | |||||
| NRTI | 23 (95.8%) |
12 (100.0%) |
35 (97.2%) |
36 (100.0%) |
71 (98.6%) |
| NNRTI | 22 (91.7%) |
12 (100.0%) |
34 (94.4%) |
36 (100.0%) |
70 (97.2%) |
| PI | 20 (83.3%) |
8 (66.7%) |
28 (77.8%) |
30 (83.3%) |
58 (80.6%) |
| INSTI | 20 (83.3%) |
7 (58.3%) |
27 (75.0%) |
23 (63.9%) |
50 (69.4%) |
| 主要な4つのクラス全て | 14 (58%) |
3 (25%) |
17 (47%) |
16 (44%) |
33 (46%) |
| EIに対する耐性を示した患者[例数(%)]*2 | |||||
| Enfuvirtide*3 | 2/23 (9%) |
3/10 (30%) |
5/33 (15%) |
0/25 | 5/58 (9%) |
| Fostemsavir*3 | 5/23 (22%) |
5/10 (50%) |
10/33 (30%) |
7/21 (33%) |
17/54 (31%) |
| Ibalizumab*3 | 8/23 (35%) |
3/10 (30%) |
11/33 (33%) |
6/25 (24%) |
17/58 (29%) |
| マラビロク*4 | 19/24 (79%) |
8/11 (73%) |
27/35 (77%) |
14/26 (54%) |
41/61 (67%) |
| OBRの構成[例数(%)] | |||||
| NRTI | 23 (96%) |
9 (75%) |
32 (89%) |
29 (81%) |
61 (85%) |
| INSTI*5 | 16 (67%) |
9 (75%) |
25 (69%) |
22 (61%) |
47 (65%) |
| PI*5 | 12 (50%) |
9 (75%) |
21 (58%) |
24 (67%) |
45 (63%) |
| NNRTI | 6 (25%) |
5 (42%) |
11 (31%) |
14 (39%) |
25 (35%) |
| Ibalizumab*3 | 9 (38%) |
3 (25%) |
12 (33%) |
5 (14%) |
17 (24%) |
| マラビロク | 2 (8%) |
4 (33%) |
6 (17%) |
4 (11%) |
10 (14%) |
| Fostemsavir*3 | 3 (13%) |
0 | 3 (8%) |
5 (14%) |
8 (11%) |
| Enfuvirtide*3 | 1 (4.2%) |
2 (17%) |
3 (8%) |
2 (6%) |
5 (7%) |
| OBRの総合感受性スコア(OSS)[中央値]*6 | 2.0 | 1.5 | 2.0 | 2.0 | 2.0 |
| OBRにおける完全な活性を示す薬剤数(fully active drugs)[例数(%)] | |||||
| 0 | 4 (16.7%) |
2 (16.7%) |
6 (16.7%) |
6 (16.7%) |
12 (16.7%) |
| 1 | 7 (29.2%) |
6 (50.0%) |
13 (36.1%) |
13 (36.1%) |
26 (36.1%) |
| 2 | 9 (37.5%) |
1 (8.3%) |
10 (27.8%) |
10 (27.8%) |
20 (27.8%) |
| ≧3 | 4 (16.7%) |
3 (25.0%) |
7 (19.4%) |
7 (19.4%) |
14 (19.4%) |
EI:侵入阻害剤、INSTI:インテグラーゼ阻害剤、NNRTI:非核酸系逆転写酵素阻害剤、NRTI:核酸系逆転写酵素阻害剤、PI:プロテアーゼ阻害剤、OBR:最適なバックグラウンドレジメン
BMI:Body mass index=[体重(kg)/身長(cm)2]×10,000、OSS:Overall susceptibility score
- *1コホート2の2例は、スクリーニング時にHIV-1 RNA量が400 copies/mL超であったが、ベースライン時には50 copies/mL未満であった。
- *272例はEIに対する感受性試験を受けた。これらの薬剤について利用可能なデータを有する患者を分母で表す。
- *3国内未承認薬
- *4マラビロクに対する感受性は、Trofile co-receptor tropism assay(Monogram Biosciences, South San Francisco, CA, USA)を用いて評価され、このassayにより、マラビロクの活性がcoreceptor(CCR5、CXCR4、又はdual mix)に基づくかどうかが示される。
- *572例中24例(33%)がドルテグラビルを1⽇2回服⽤し、72例中22例(31%)がブーストされたダルナビルを1⽇2回服用した。
- *6薬剤感受性スコア(遺伝子型、表現型、及び全体;完全な場合は1、部分的な場合は0.5、感受性なしの場合は0)は、独自のアルゴリズムに基づいて決定した。過去の耐性報告については、治験担当医師によって提供されたデータから得た。OBRの総合感受性スコアは、個々のスコアの合計であった。







