本剤の「警告・禁忌を含む使用上の注意」等については
注意事項等情報(電子化された添付文書)をご参照ください。
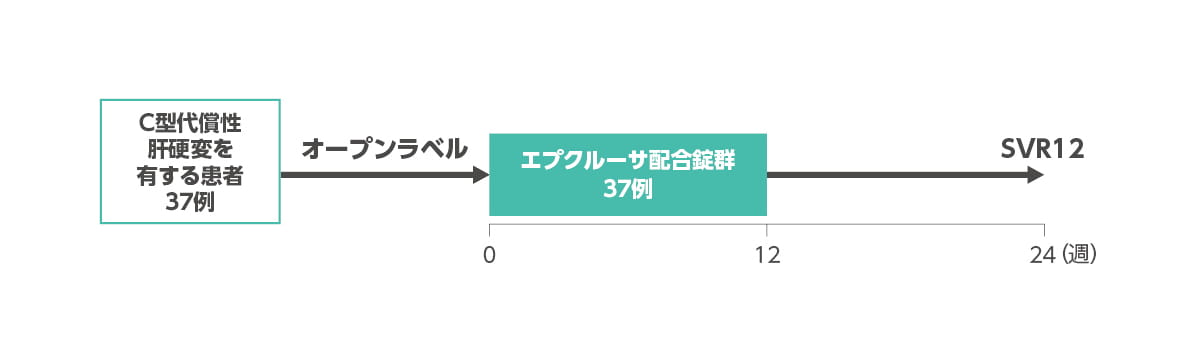
C型代償性肝硬変患者を対象とした国内第3相臨床試験
エプクルーサ配合錠を1日1回1錠、12週間服用することで、 C型代償性肝硬変患者さんにおいてジェノタイプ、前治療歴の有無、年齢に関わらず、血中HCV RNA量は投与8週目に全例で定量下限未満になり、全ての患者さんがSVR12を達成しました。また、37例中4例(10.8%)に副作用が認められました。
試験概要
| 目的 | 未治療又はインターフェロン含有レジメンで治療歴のあるC 型代償性肝硬変を有する患者を対象にエプクルーサ配合錠12週間投与の有効性と安全性を検討する。 |
|---|---|
| 対象 | C型代償性肝硬変を有する患者37例(ジェノタイプは問わない)。 |
| 試験デザイン | 多施設共同、非盲検試験。 |
| 方法 | エプクルーサ配合錠を食事の有無を問わず、1日1回1錠、12週間経口投与した。 |
| 主要評価項目 | SVR12率[投与終了から12週間後のHCV RNA量が定量下限 (LLOQ)†未満を達成した患者割合]、安全性。 |
| 副次評価項目 | SVR4率、SVR24率、ウイルス学的治療不成功の患者割合。 |
| その他の有効性評価項目 | 投与期間中HCV RNA量がLLOQ†未満である患者の割合、ベースラインから投与終了までのHCV RNA量の変化量。 |
| 解析計画 | 主要評価項目はFull Analysis Set(FAS)においてSVR12を達成した患者の割合(SVR12率)とした。有意水準を0.05とする両側正確1 標本二項検定により、閾値として設定した78%と比較し、統計学的優越性の仮説検定を行い、さらに二項分布(Clopper-Pearson 法)を用いてSVR12率の点推定値及び正確な両側95%信頼区間(CI)を算出した。背景因子別のサブグループ解析は、ジェノタイプ/サブタイプ、年齢、前治療歴、ベースライン時のNS5A及びNS5B耐性関連変異の有無等について実施することにした。 |
SVR:
sustained virologic response(持続的ウイルス陰性化)
†
定量下限(LLOQ):本試験のHCV RNA量の定量にはCOBAS® AmpliPrep /COBAS® TaqMan® HCV Quantitative Test
v2.0を用い、本分析法の定量下限(LLOQ)は15IU/mLでした。
◆ C型代償性肝硬変を有する患者を対象とした国内第3相臨床試験:試験デザイン
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
【用法・用量】(抜粋)
〈未治療又は前治療歴のないC型慢性肝炎又はC型代償性肝硬変におけるウイルス血症の改善〉
通常、成人には、1日1回1錠(ソホスブビルとして400mg 及びベルパタスビルとして100mg)を12 週間経口投与する。
患者背景
患者背景
| エプクルーサ配合錠12週間投与群(n=37) | ||||
| 全体(n=37) | GT1※1(n=23) | GT2※2(n=14) | ||
| 年齢中央値(範囲) | 66歳(41-85) | 70歳(41-85) | 62歳(49-78) | |
| ≧65歳 | 21例(56.8%) | 15例(65.2%) | 6例(42.9%) | |
| 男性 | 20例(54.1%) | 12例(52.2%) | 8例(57.1%) | |
| BMI(平均値±標準偏差), kg/m2 | 24.1±3.86 | 23.8±3.95 | 24.6±3.79 | |
| IL28B 遺伝子型 | CC | 28例(75.7%) | 17例(73.9%) | 11例(78.6%) |
| Non-CC | 9例(24.3%) | 6例(26.1%) | 3例(21.4%) | |
| CT | 9例(24.3%) | 6例(26.1%) | 3例(21.4%) | |
| HCV RNA量(平均値±標準偏差), log10 IU/mL(範囲) | 6.0±0.80 (4.0~7.0) |
6.2±0.74 (4.0~7.0) |
5.6±0.78 (4.0~6.5) |
|
| HCV RNA≧800,000 IU/mL | 27例(73.0%) | 20例(87.0%) | 7例(50.0%) | |
| 前治療歴 | なし | 29例(78.4%) | 16例(69.6%) | 13例(92.9%) |
| あり | 8例(21.6%) | 7例(30.4%) | 1例(7.1%) | |
| 前治療 | Peg-IFN | 1/8例 | 0 例 | 1/1例 |
| その他※3 | 7/8例 | 7/7例 | 0 例 | |
| 前治療結果 | 再発/ブレイクスルー | 1/8例 | 0 例 | 1/1例 |
| 治療中断 | 4/8例 | 4/7例 | 0 例 | |
| 不明 | 3/8例 | 3/7例 | 0 例 | |
| eGFRCG 中央値 (範囲) mL/min | 72.6(37.2-190.2) | 68.4(37.2-190.2) | 79.2(42.6-148.8) | |
| NS5A 耐性関連変異 |
なし | 20例(54.1%) | 16例(69.6%) | 4例(28.6%) |
| あり | 17例(45.9%) | 7例(30.4%) | 10例(71.4%) | |
| NS5B 耐性関連変異 |
なし | 34例(91.9%) | 21例(91.3%) | 13例(92.9%) |
| あり | 3例(8.1%) | 2例(8.7%) | 1例(7.1%) | |
- ジェノタイプ1a 1例、ジェノタイプ1b 22例。
- ジェノタイプ2a 7例、ジェノタイプ2b 7例。
- IFN±PI又はNS3/4A。
eGFRCG (mL/min) = [(140 (年齢)) × 体重 (kg) × (女性の場合は0.85 )] / (血清クレアチニン (mg/dL) × 72)。
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
SVR12率(主要評価項目、サブグループ解析)
エプクルーサ配合錠12週間投与によるSVR12率(投与終了12週間後の持続的ウイルス陰性化率)は100.0%(37/37例、95%CI:90.5~100.0%)でした(主要評価項目)。あらかじめ規定した78%の閾値に対して統計学的優越性(p<0.001、両側正確1標本二項検定)を示しました。ジェノタイプ別SVR12率は、ジェノタイプ1が100.0%(23/23 例)、ジェノタイプ2 が100.0%(14/14 例)でした(サブグループ解析)。
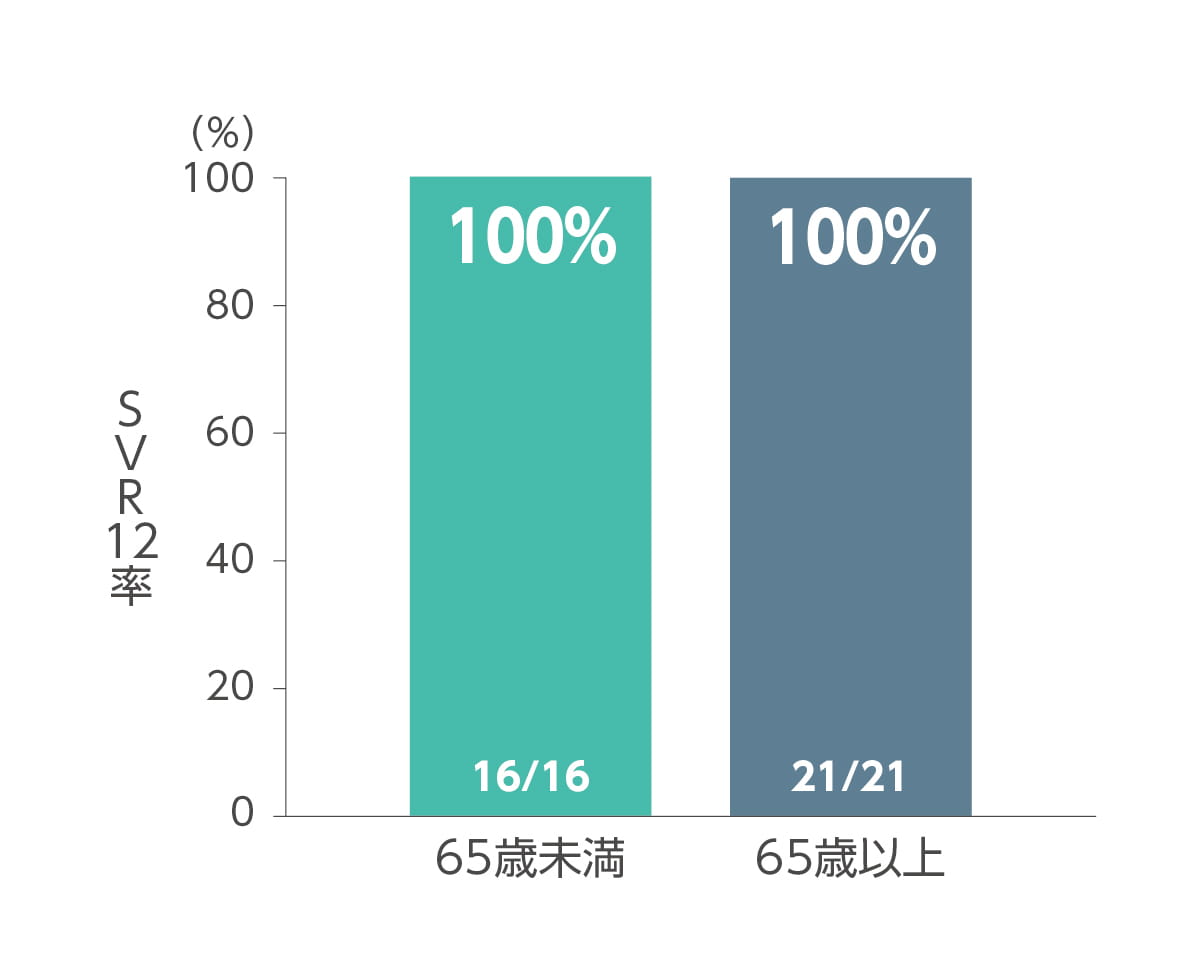
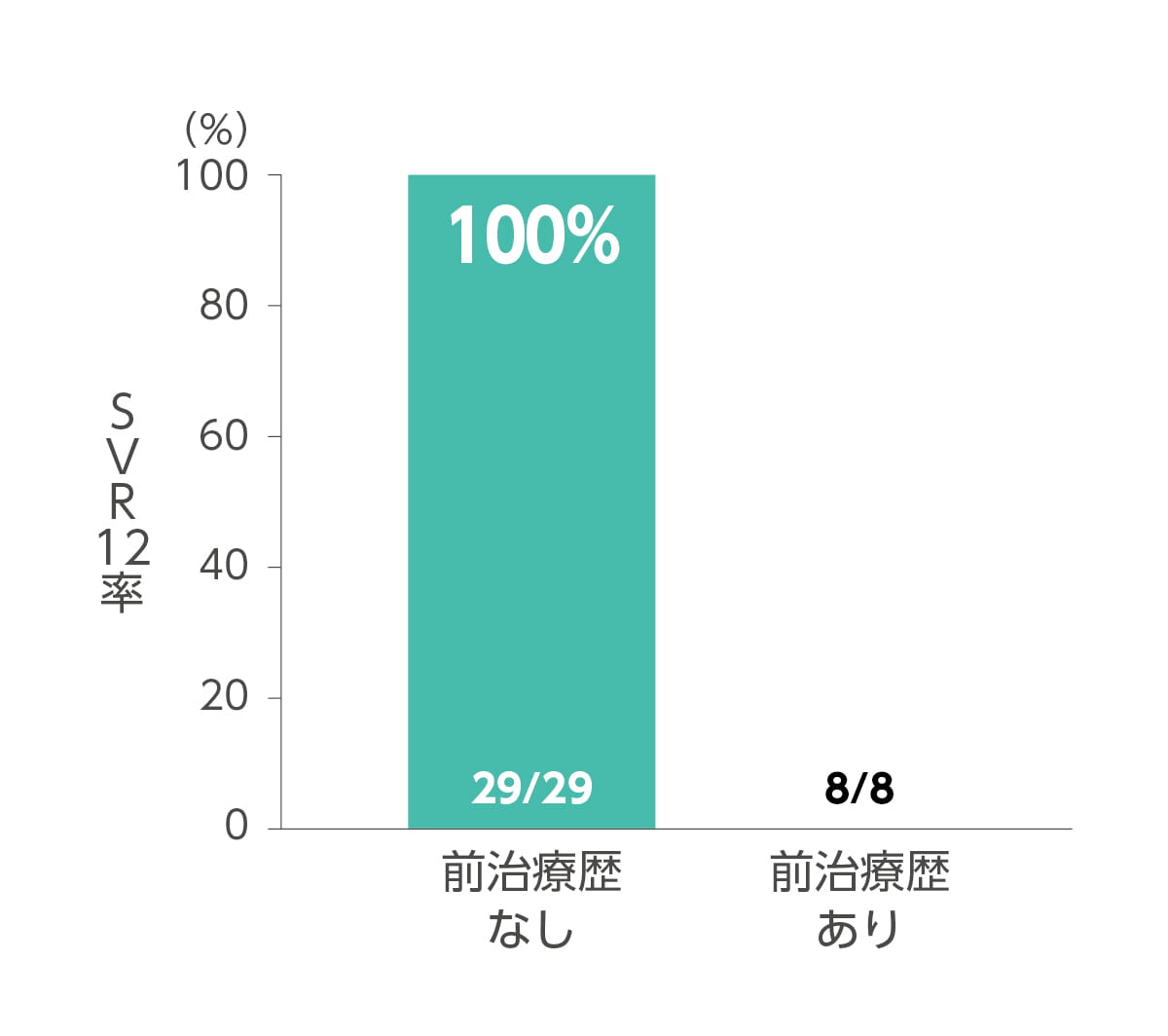
その他の背景因子別(ジェノタイプ、年齢、前治療歴の有無)のSVR12率は以下のとおりです。なお本試験では、対象患者37例の全例が本剤の投与を完遂しました。
◆ SVR12率*(主要評価項目)
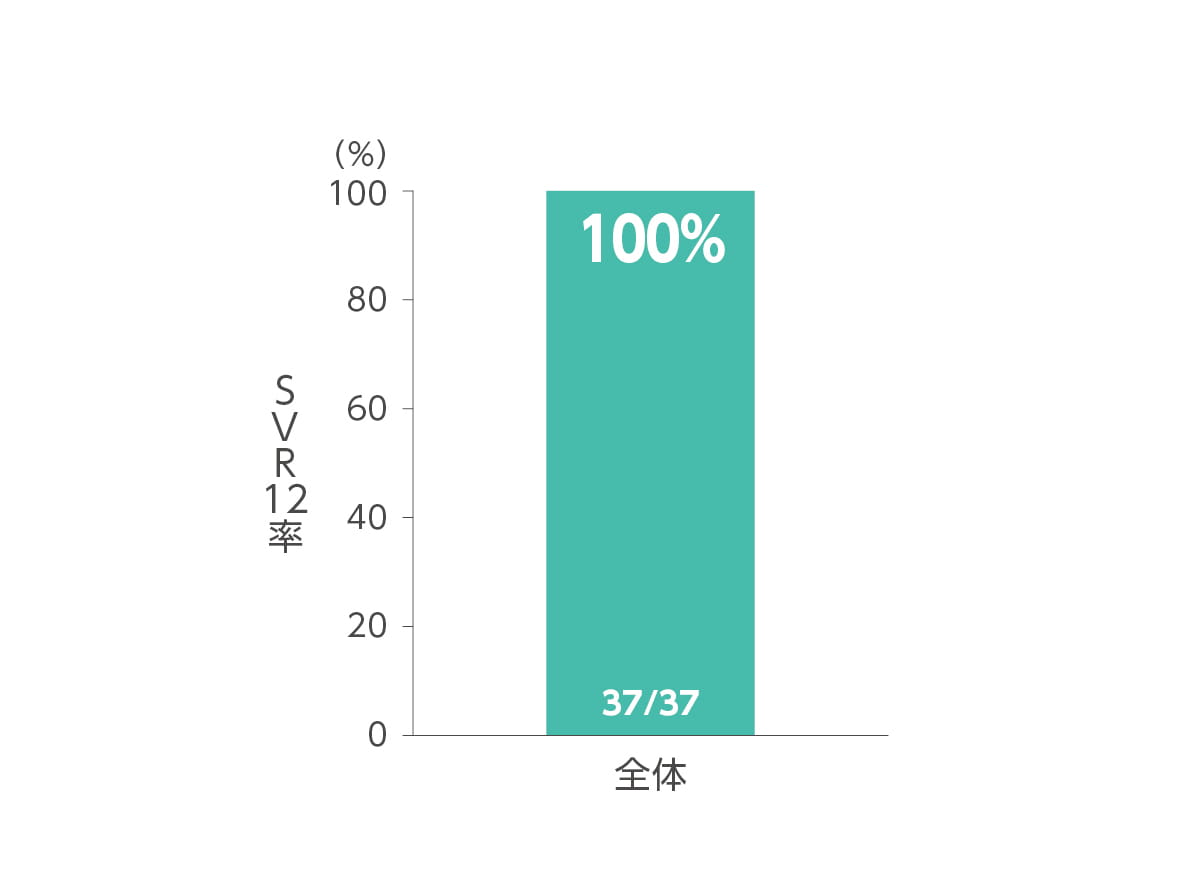
* 投与終了12週間後の持続的ウイルス陰性化率。
◆ ジェノタイプ別SVR12率(サブグループ解析)
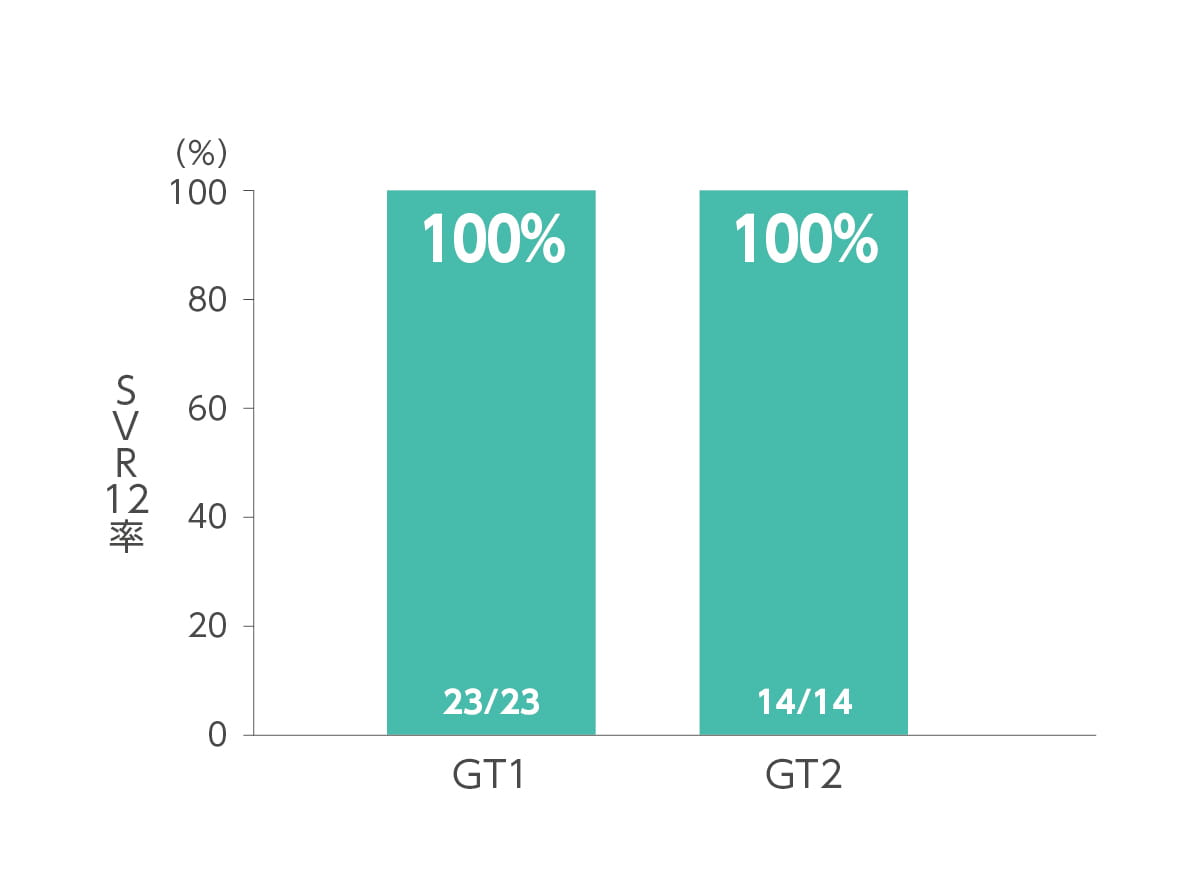
GT1:ジェノタイプ1a 1例、ジェノタイプ1b 22例
GT2:ジェノタイプ2a 7例、ジェノタイプ2b 7例
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
背景因子別SVR12率(サブグループ解析)
背景因子別SVR12率は以下の通りです。
◆ 年齢別SVR12率
** インターフェロン含有レジメン。
◆ 前治療歴**有無別SVR12率
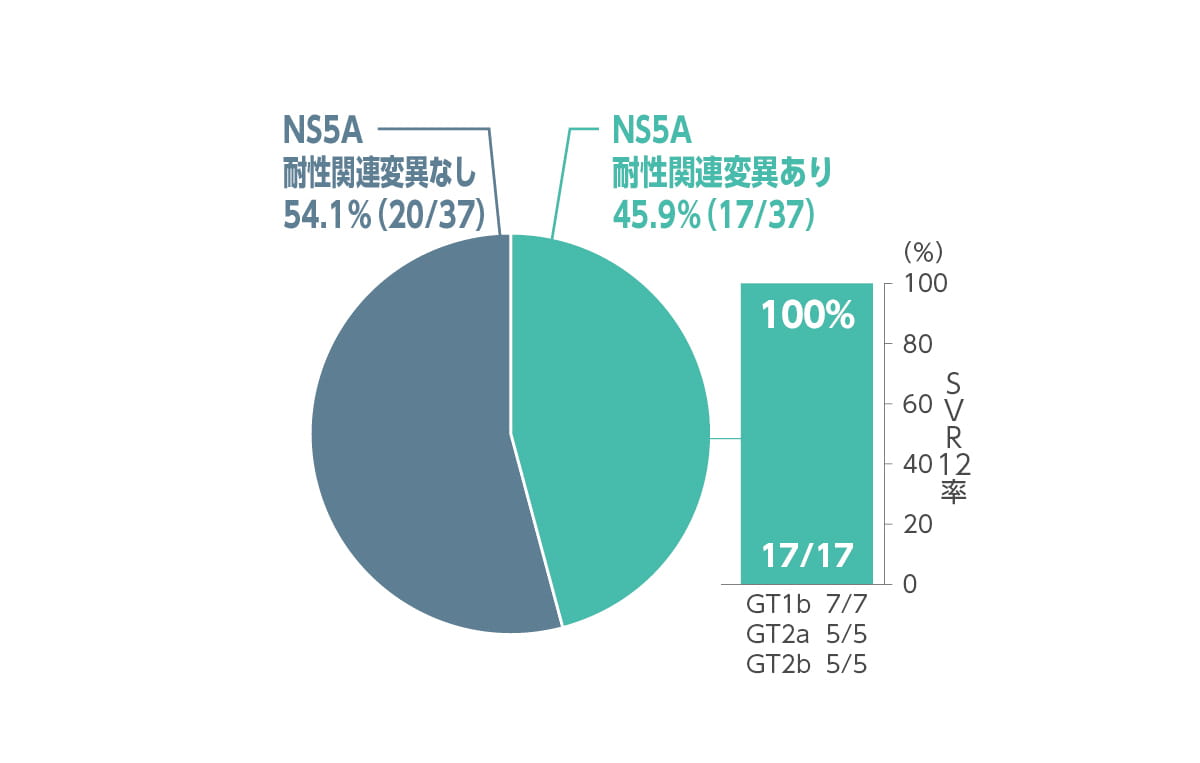
◆ ベースライン時のNS5A及びNS5B耐性関連変異の有無別SVR12率(サブグループ解析)
ベースライン時に45.9%(17/37 例)でNS5A 耐性関連変異(RAS)が認められました。内訳はジェノタイプ1(1b)で7/23例(30.4%)、ジェノタイプ2で10/14例(71.4%、ジェノタイプ2a:5例、ジェノタイプ2b:5例)でした。これら17例全てでSVR12を達成しました。
また、ベースライン時に8.1%(3/37 例)でNS5B 核酸型阻害薬(NI)関連RAS(NS5B NIRAS)が認められました。内訳はジェノタイプ1(1b)で2/23 例(8.6%)にV321I 変異、ジェノタイプ2(2b)で1/14例(7.1%)にM289I 変異がありました。これら3例全てでSVR12を達成しました。
投与終了後12週までに投与中のブレイクスルー又は再燃は認められませんでした。
◆ ベースライン時のNS5A耐性関連変異の有無別SVR12率
| サブタイプ | NS5A耐性関連変異 | 例数 | 治療転帰 | |
| ジェノタイプ1 (7例) |
1b | R30Q | 1 | SVR12達成 |
| 1b | Y93H | 1 | SVR12達成 | |
| 1b | Y93Y/H | 3 | SVR12達成 | |
| 1b | Q24R+R30Q | 1 | SVR12達成 | |
| 1b | Q24K+R30Q | 1 | SVR12達成 | |
| ジェノタイプ2 (10例) |
2a | L31M | 5 | SVR12達成 |
| 2b | L31M | 1 | SVR12達成 | |
| 2b | L31I/M | 1 | SVR12達成 | |
| 2b | C92S | 1 | SVR12達成 | |
| 2b | L28L/F+L31M | 1 | SVR12達成 | |
| 2b | L31M+C92S | 1 | SVR12達成 |
◆ ベースライン時のNS5B耐性関連変異検出例でのSVR12率
| サブタイプ | NS5B耐性関連変異 | 例数 | 治療転帰 | |
| ジェノタイプ1 | 1b | V321I | 2 | SVR12達成 |
| ジェノタイプ2 | 2b | M289I | 1 | SVR12達成 |
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
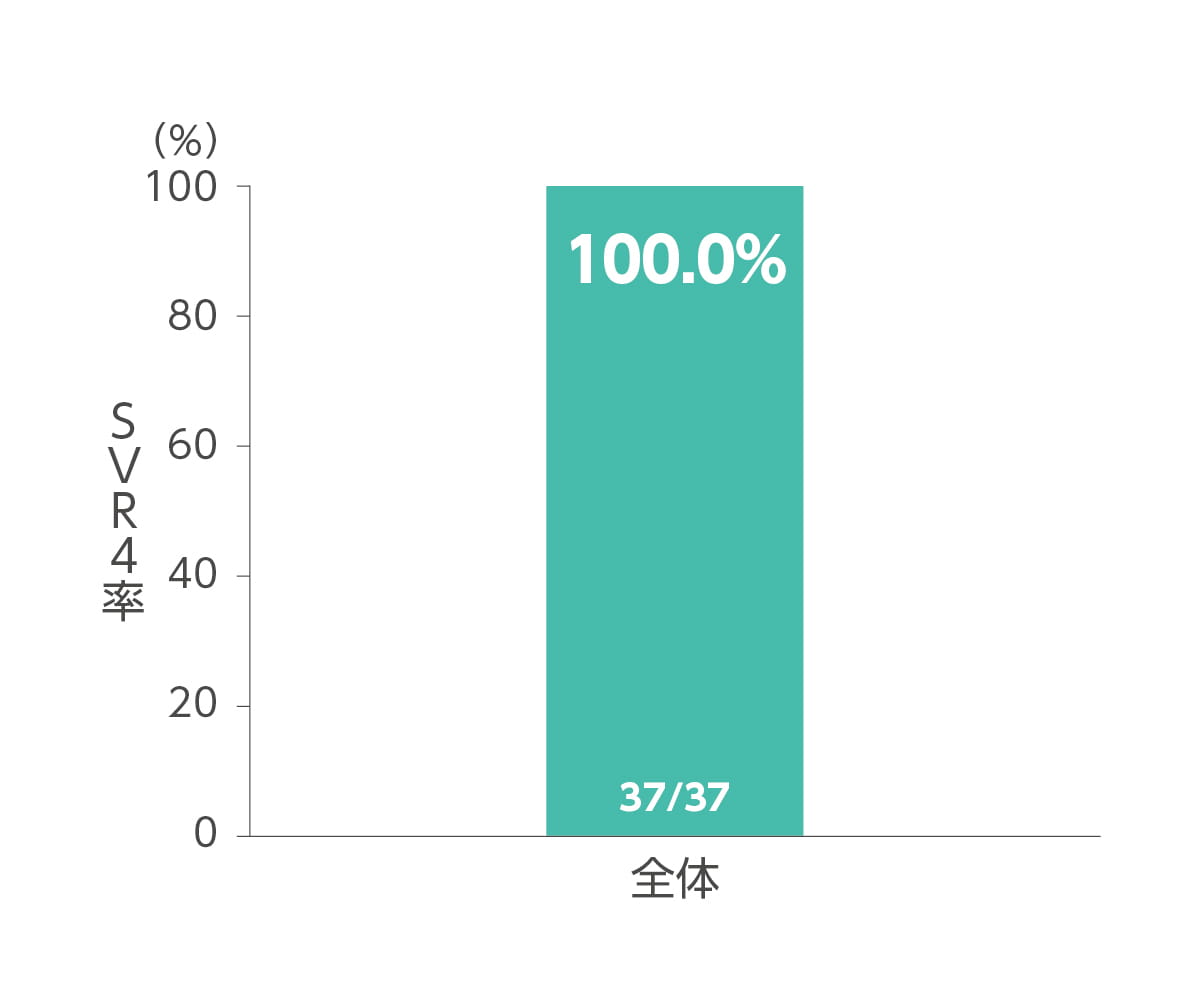
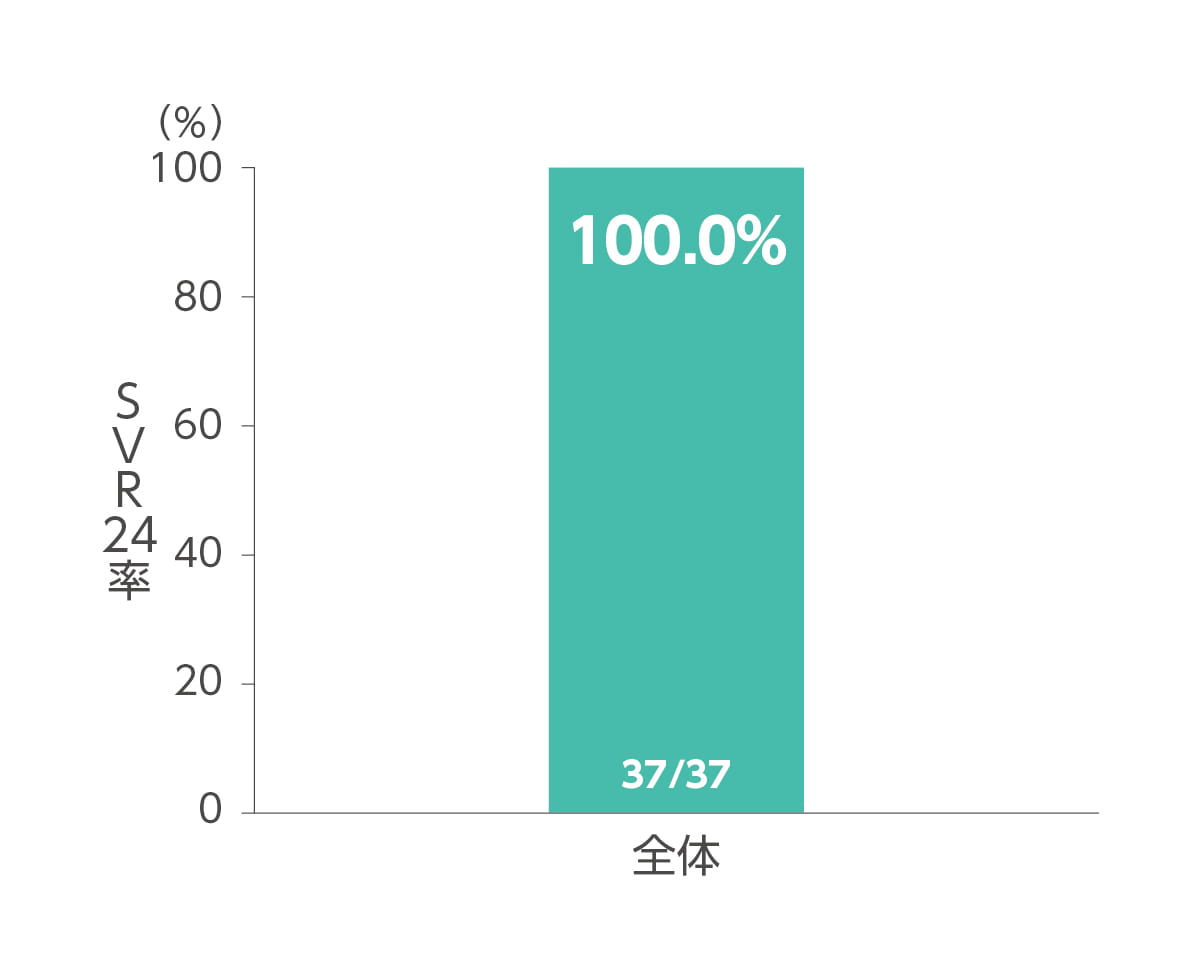
SVR4率及びSVR24率(副次評価項目)
エプクルーサ配合錠12週間投与によるSVR4率(投与終了4週間後の持続的ウイルス陰性化率)及びSVR24率(投与終了24週間後の持続的ウイルス陰性化率)はともに100%(37/37 例)でした(副次評価項目)。
◆ SVR4率*(副次評価項目)
* 投与終了4週間後のウイルス持続陰性化率。
** 投与終了24週間後のウイルス持続陰性化率。
◆ SVR24率**(副次評価項目)
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
治療完遂率*(参考情報)
エプクルーサ配合錠投与例37例中37例(100%)が12週間の投与による治療を完遂しました。
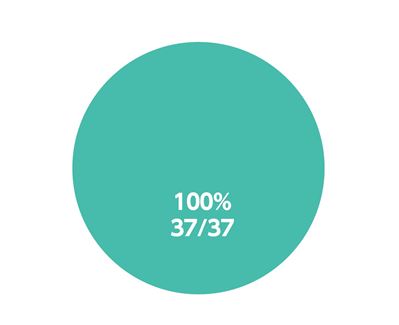
* 途中、中止することなく12週間、継続して服用した患者の割合。
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
ウイルス学的治療不成功の患者の割合(副次評価項目)
再燃又は投与中のウイルス学的治療不成功例は認められませんでした。
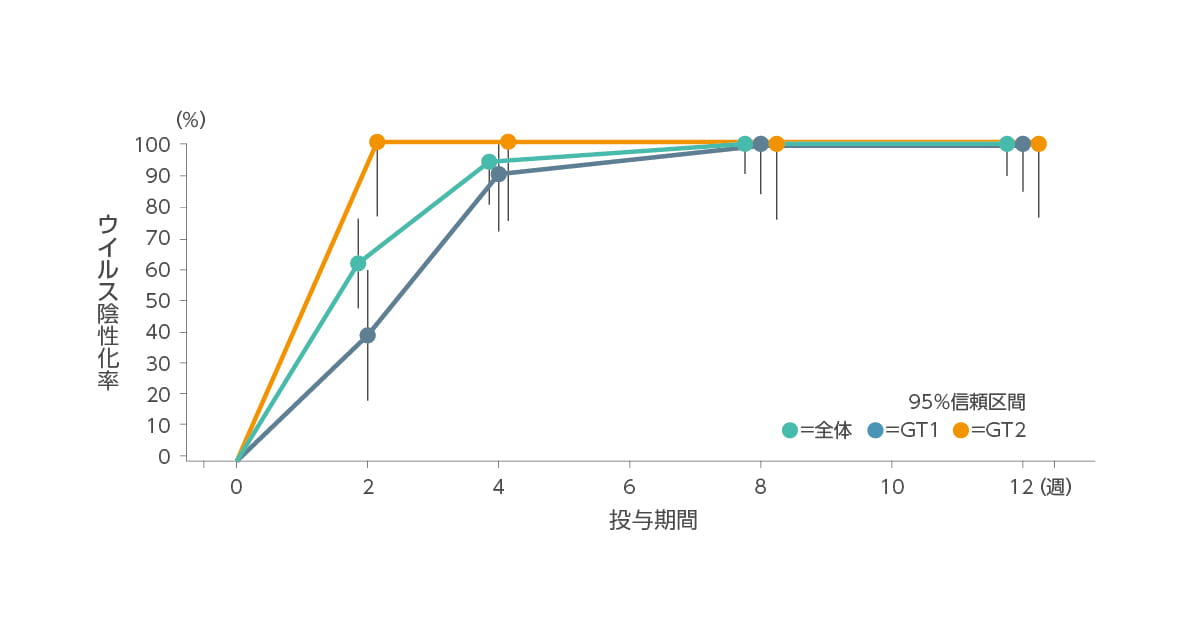
ウイルス陰性化率の推移(副次評価項目)
投与開始後、ウイルス陰性化率は2週目に62.2%(23 例)、4週目に94.6%(35 例)、8週目に100.0%(37例)に達して12週まで持続しました。
◆ ウイルス陰性化率の推移
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
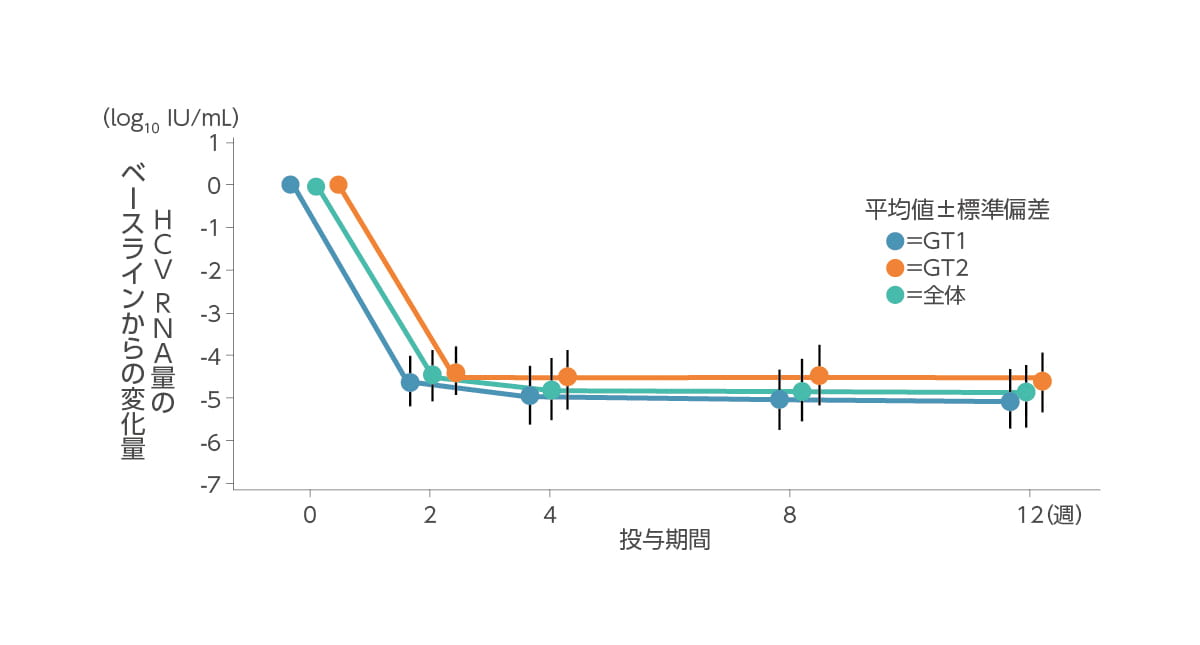
ベースラインから投与終了までのHCV RNA量(log10 IU/mL)の変化量(その他の有効性評価項目)
投与開始後、血中HCV RNA量の変化量は下記のとおりでした。
◆ HCV RNA量のベースラインからの変化量
◆ ウイルス陰性化率※(%)(副次評価項目)
| 投与期間 | 0週間 | 2週間 | 4週間 | 8週間 | 12週間 |
| GT1(n=23) | 0 | 39.1 | 91.3 | 100 | 100 |
| GT2(n=14) | 0 | 100 | 100 | 100 | 100 |
| 全体(n=37) | 0 | 62.2 | 94.6 | 100 | 100 |
- HCV RNA量<LLOQ(15IU/mL)
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
安全性(主要評価項目)
【副作用発現状況】
37 例中4 例(10.8%)に副作用が認められました。主な副作用は、頭痛2 例(5.4%)、ざ瘡、高尿酸血症、悪心、そう痒症、体重減少が各1例(2.7%)でした。
本剤と関連のある死亡例、重篤な有害事象及び投与中止に至った有害事象は報告されませんでした。
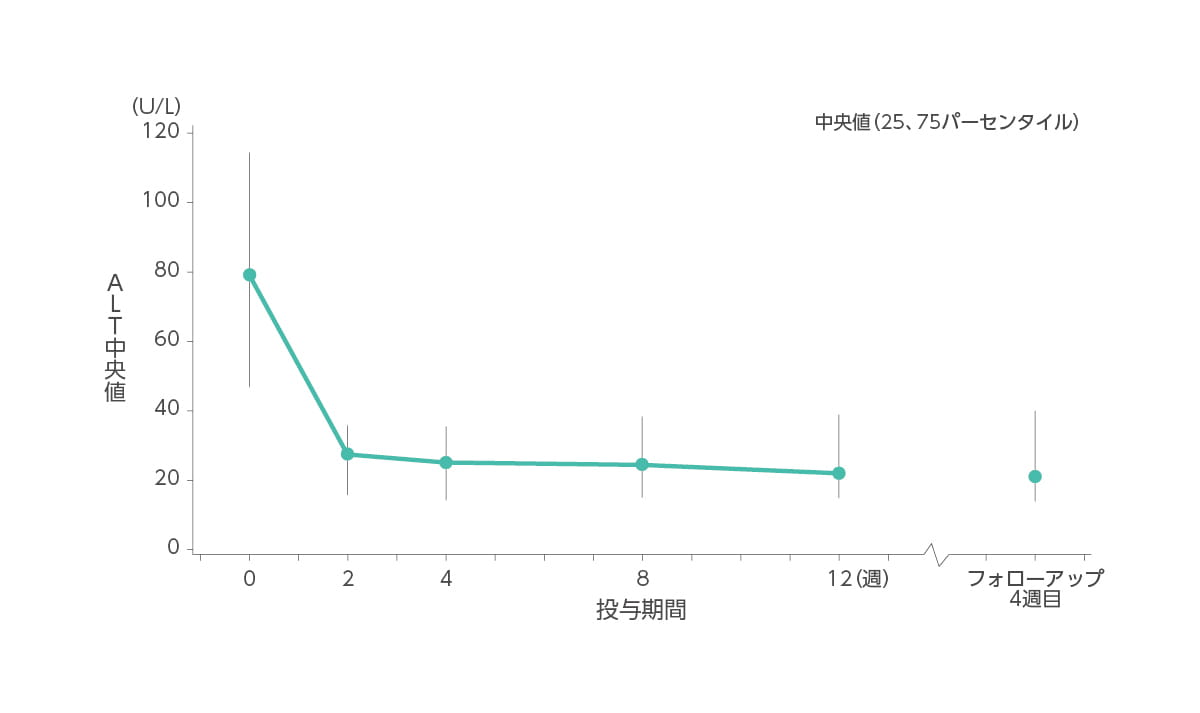
【ALT値の推移】承認時評価資料であるため紹介します。
ALT(中央値)はベースライン時79U/L、2週時28U/L、4週時25U/L、8週時25U/L、12週時22U/L、フォローアップ4週目21U/Lでした。
◆ ALT(中央値)の推移
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
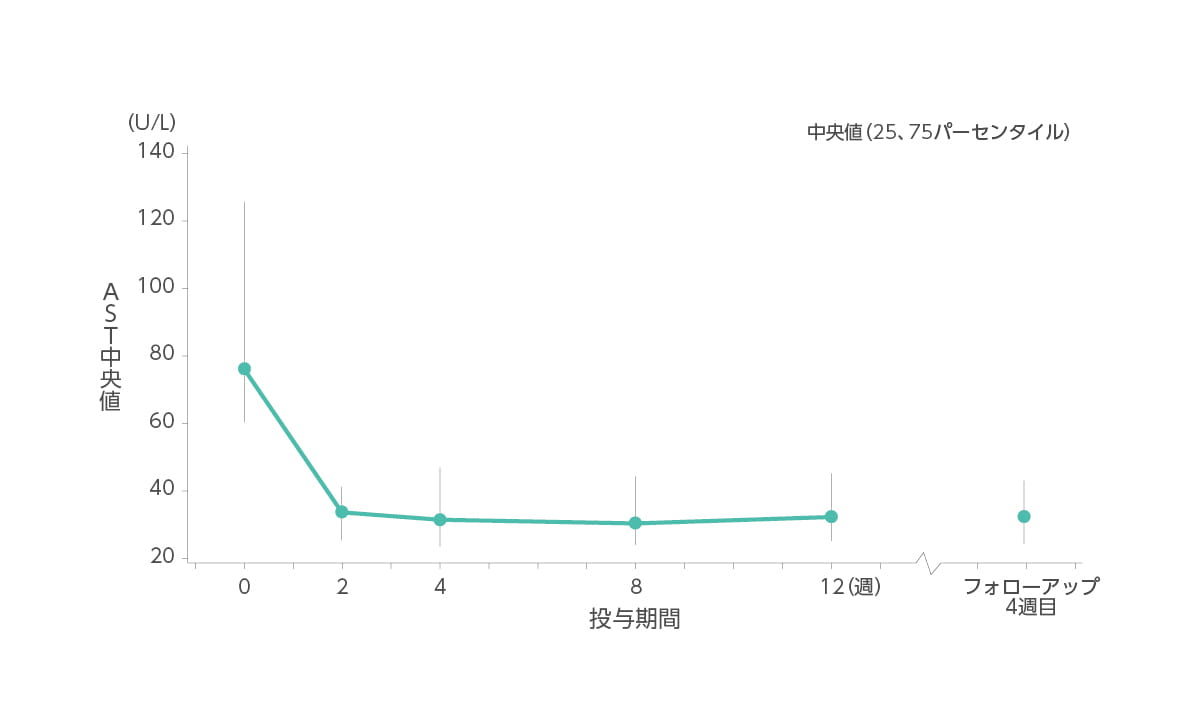
【AST値の推移】承認時評価資料であるため紹介します。
AST(中央値)はベースライン時76U/L、2週時34U/L、4週時31U/L、8週時30U/L、12週時32U/L、フォローアップ4週目32U/Lでした。
◆ AST(中央値)の推移
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
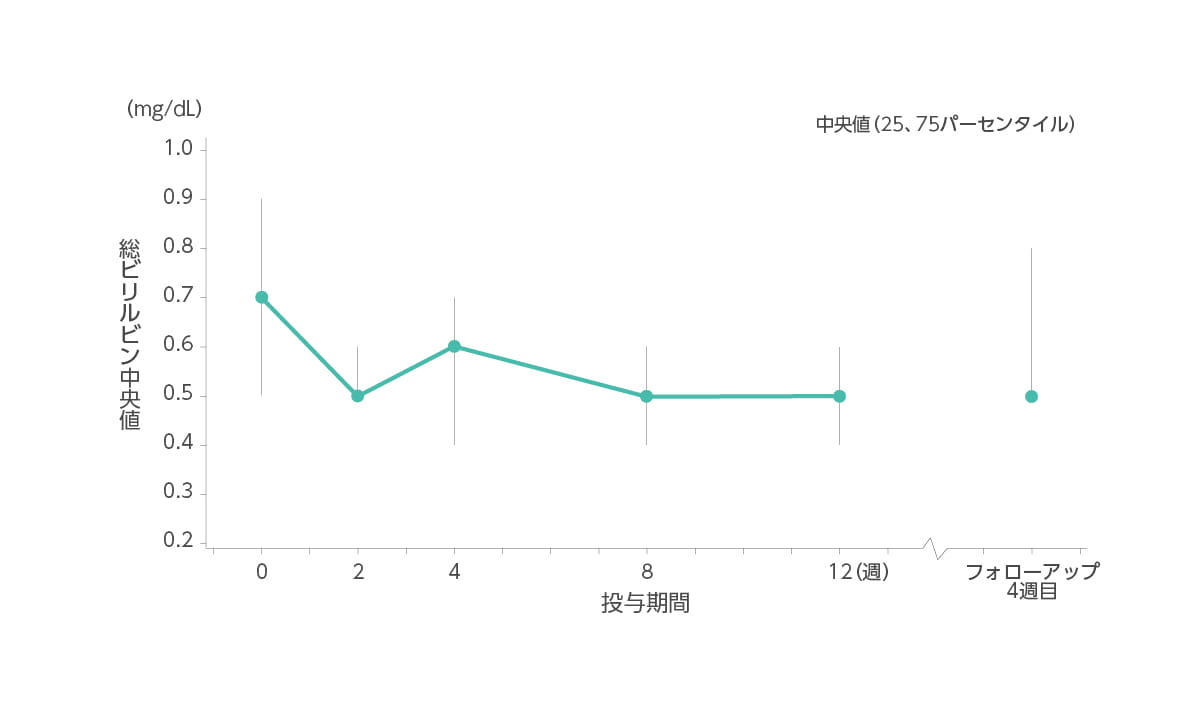
【総ビリルビン値の推移】承認時評価資料であるため紹介します。
総ビリルビン値(中央値)はベースライン時0.7mg/dL、2週時0.5mg/dL、4週時0.6mg/dL、8週時0.5mg/dL、12週時0.5mg/dL、フォローアップ4週目0.5mg/dLでした。
◆ 総ビリルビン(中央値)の推移
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
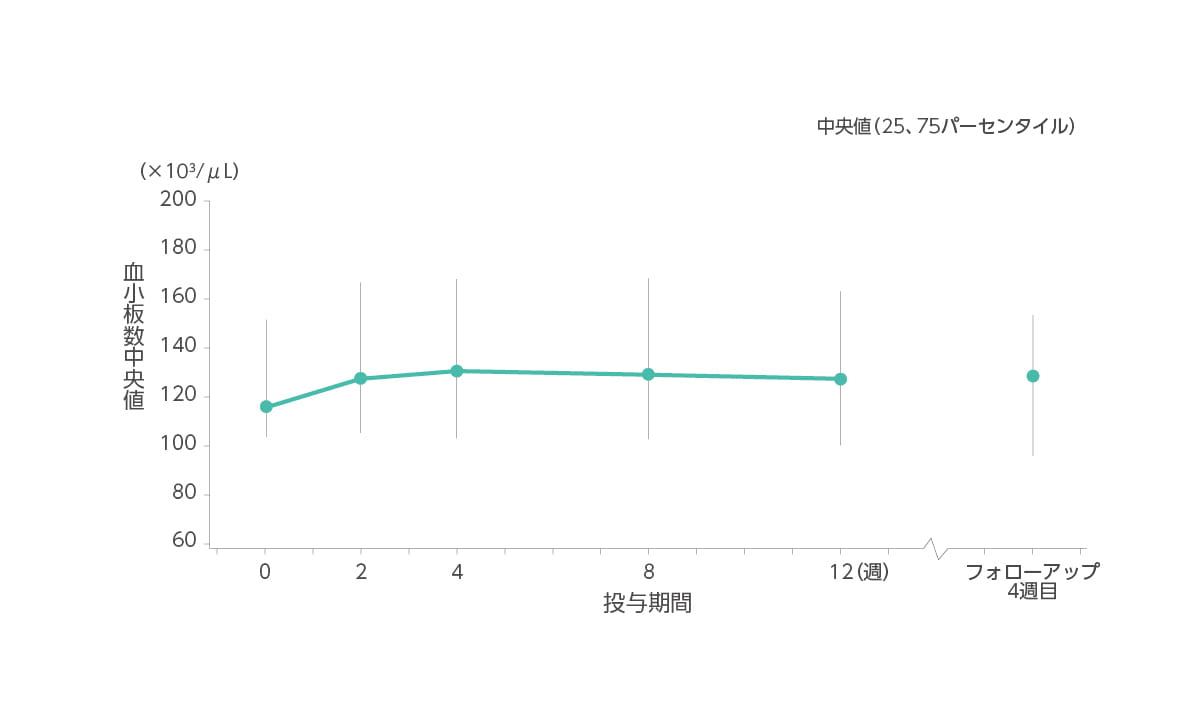
【血小板数の推移】承認時評価資料であるため紹介します。
血小板数(中央値)はベースライン時117(×103/μL)、2 週時128(×103/μL)、4週時131(×103/μL)、8週時130(×103/μL)、12週時127(×103/μL)、フォローアップ4週目128(×103/μL)でした。
◆ 血小板数(中央値)の推移
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]
副作用
37例中4例(10.8%)に副作用が認められました。主な副作用は、頭痛2例(5.4%)、ざ瘡、高尿酸血症、悪心、そう痒症、体重減少が各1例(2.7%)でした。
本剤と関連のある死亡例、重篤な有害事象及び投与中止に至った有害事象は報告されませんでした。
◆ C型代償性肝硬変患者を対象とした国内第3相臨床試験
| 安全性評価対象例数 | 37例 |
|---|---|
| 副作用発現症例数 | 4例 |
| 副作用発現症例率 | 10.8% |
| エプクルーサ配合錠 12週間投与群 |
|
|---|---|
| 副作用発現例数(%) | 4(10.8%) |
| 副作用の種類、例数(%) | |
| 胃腸障害 | 1(2.7%) |
悪心 |
1(2.7%) |
| 代謝及び栄養障害 | 1(2.7%) |
高尿酸血症 |
1(2.7%) |
| 神経系障害 | 2(5.4%) |
頭痛 |
2(5.4%) |
| 皮膚及び皮下組織障害 | 2(5.4%) |
ざ瘡 |
1(2.7%) |
そう痒症 |
1(2.7%) |
| 臨床検査 | 1(2.7%) |
体重減少 |
1(2.7%) |
有害事象名は ICH 国際医薬用語集(MedDRA) Version 18.0 でコード化した。
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-342-5531)
Takehara T, et al. Hepatol Res. 2022. doi: 10.1111/hepr.13810.
[利益相反:本研究はギリアド・サイエンシズ, Inc. の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。]




