1878試験 安全性
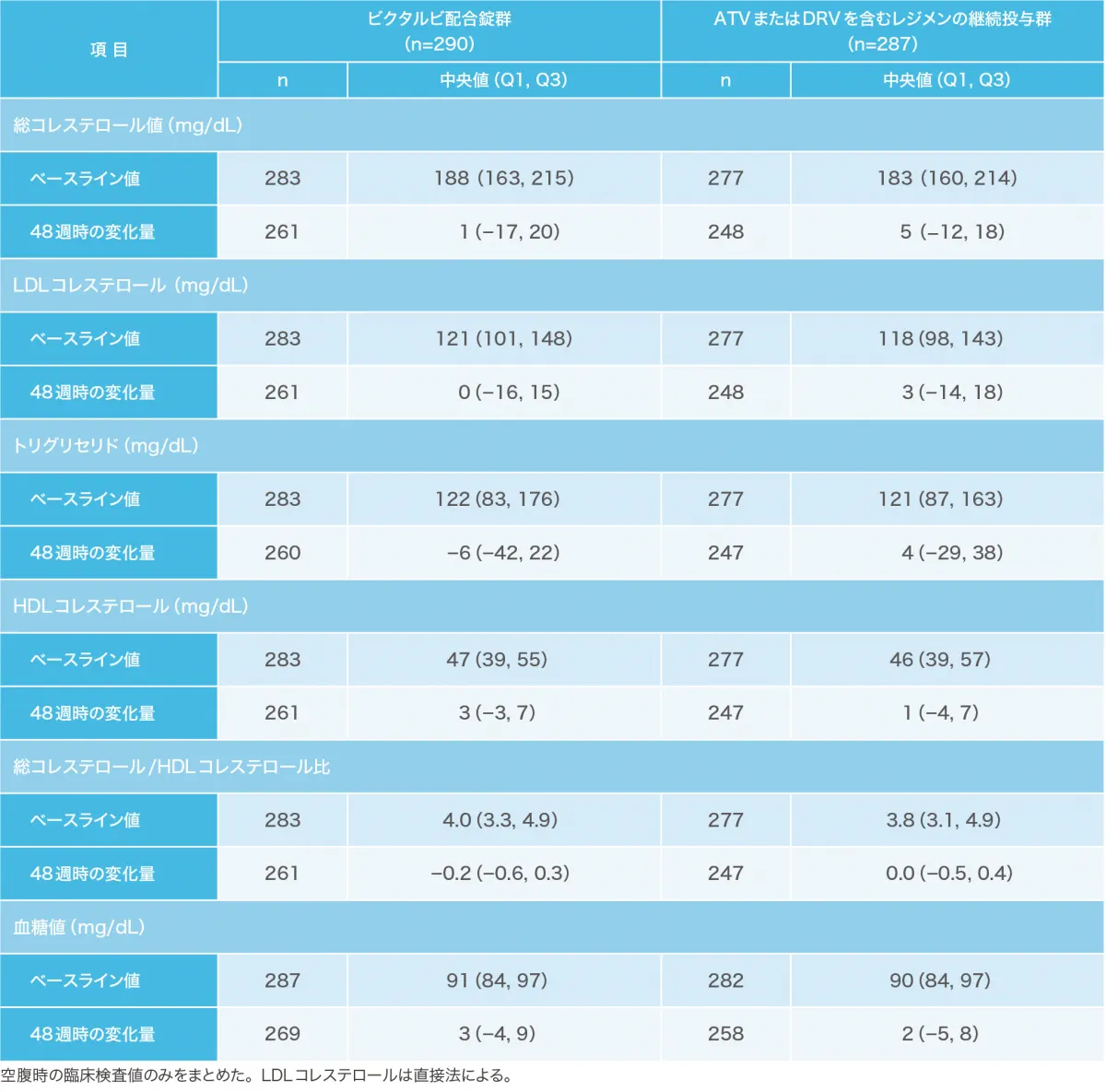
有害事象および副作用の発現状況(安全性解析対象集団)(副次評価項目)(海外データ)
投与48週時点で、ビクタルビ配合錠群で290例中54例(18.6%)、ATVまたはDRVを含むレジメンの継続投与群で287例中6例(2.1%)に臨床検査値異常を含む副作用が認められました。主な副作用は、ビクタルビ配合錠群で頭痛14例(4.8%)、鼓腸7例(2.4%)、悪心7例(2.4%)等、ATVまたはDRVを含むレジメンの継続投与群で蛋白尿2例(0.7%)等でした。
重篤な副作用として、ビクタルビ配合錠群で統合失調症1例が認められました。投与中止に至った副作用として、ビクタルビ配合錠群で統合失調症1例が認められました。死亡はビクタルビ配合錠群とATVまたはDRVを含むレジメンの継続投与群で各1例認められましたが、治験薬との関連は否定されました。
有害事象および副作用の発現割合(例数)は下表の通りです。
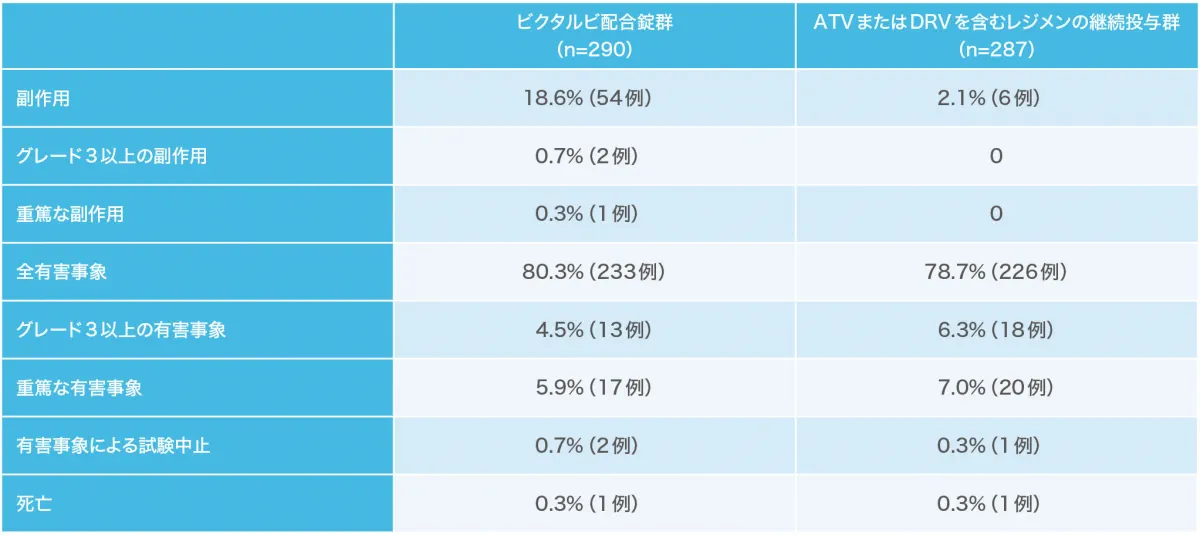
腎機能:投与48週時点における腎バイオマーカー/尿中クレアチニン比 (安全性解析対象集団)(副次評価項目)(海外データ)
ビクタルビ配合錠群において、UACRはベースラインから変化はなく、尿中RBP/クレアチニン比および尿中β2マイクログロブリン/クレアチニン比はベースラインから減少しました。
UACR:尿中アルブミン/クレアチニン比、RBP:レチノール結合蛋白、 ATV:アタザナビル、DRV:ダルナビル
*:両側ウィルコクソンの順位和検定(ビクタルビ配合錠群 vs ATVまたはDRVを含むレジメンの継続投与群)
Daar ES, et al.: Lancet HIV 2018; 5(7): e347.
社内資料(Phase 3 study : GS-US-380-1878)(承認時評価資料)
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
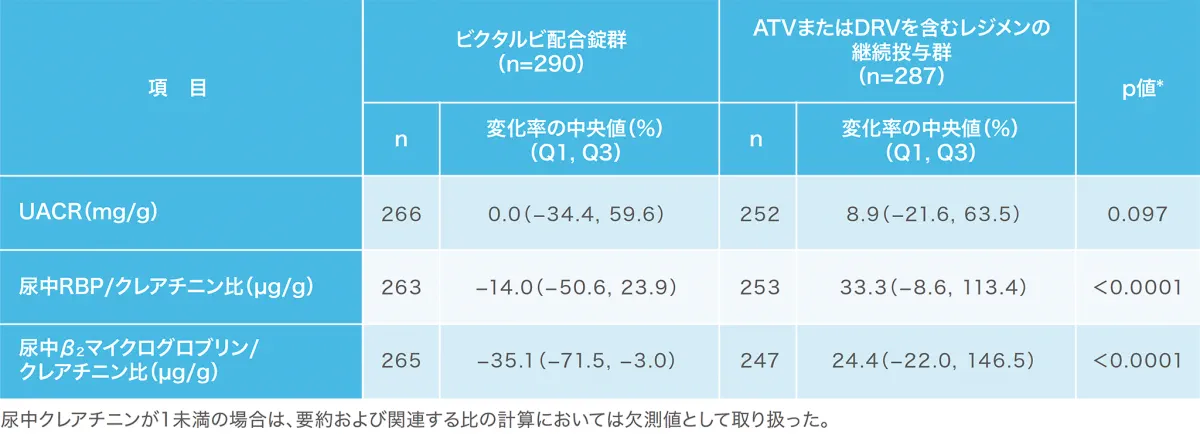
腎機能:投与48週時点における腎バイオマーカー/尿中クレアチニン比 (前治療レジメン別)(安全性解析対象集団)(副次評価項目)(海外データ)
TDF含有レジメンからビクタルビ配合錠群に切り替えた患者において、UACR*、尿中RBP†/Cr比、尿中β2マイクログロブリン/Cr比のベースラインからの変化率の中央値はそれぞれ、−2.1%、−17.7%、−40.3%であった。
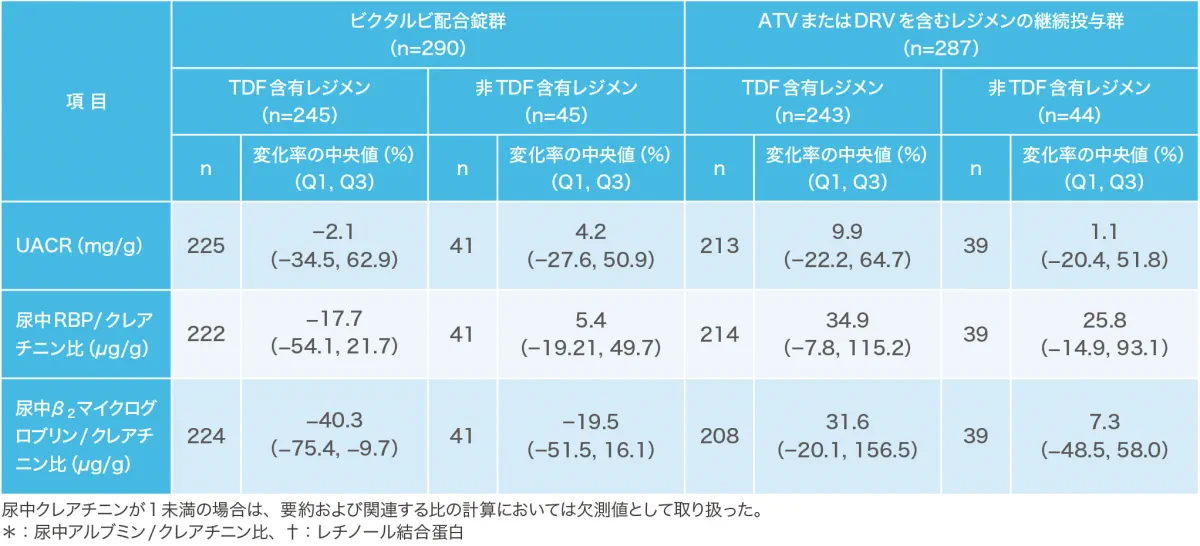
48週時における空腹時脂質・血糖パラメータのベースラインからの変化量 (安全性解析対象集団)(副次評価項目)(海外データ)