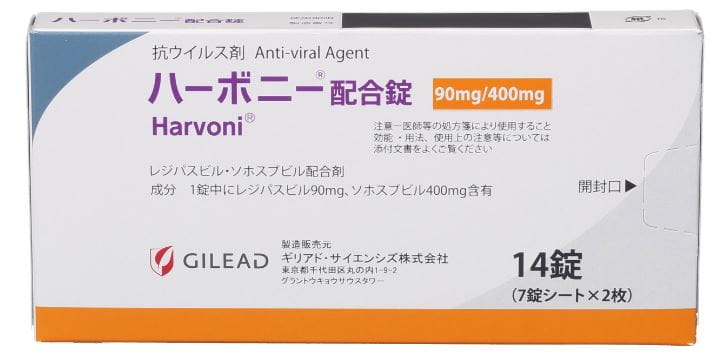
製品基本情報
- 製品名
- ハーボニー® 配合錠
- 薬価収載医薬品コード
(厚労省コード) - 6250107F1026
- 注意事項等情報
(添付文書)
作成・改訂年月 - 2025_02
- インタビューフォーム
作成・改訂年月 - 2021_03
- くすりのしおり
作成・改訂年月 - 2018_02(英語版あり)
- 患者向医薬品ガイド
- 2023_06
- レセプト
電算処理コード - 622442101
- 包 装
- 14 錠(7錠×2)PTP
- 統一商品コード
- 884000165
- HOTコード
- 1244212010201
- GS1
- 調剤包装単位コード:(01)04987884000158
販売包装単位コード:(01)14987884000162
医薬品リスク管理計画書及び関連資材
- 医薬品リスク管理計画書
作成・更新年月 - 再審査終了に伴い、承認条件としてのRMPの策定・実施が解除されたため、RMPおよびRMP資材の掲載を終了しました。