292-0106試験(106試験)(海外データ、国際共同治験)
抗HIV薬による治療経験がない小児HIV-1感染症患者(12歳以上18歳未満かつ体重35kg以上)
抗HIV薬による治療経験がない外国人小児HIV-1感染症患者(12歳以上18歳未満かつ体重35kg以上)を対象とした、ゲンボイヤ配合錠の安全性・有効性・薬物動態試験
・Gilead社:社内資料 292-0106試験[承認時評価資料]
・Gaur AH. et al. : Lancet HIV. 3 (12) : e561-e568, 2016.
〔利益相反〕本研究はGilead社の資金により実施された。
試験概要
試験の概要は以下のとおりです。
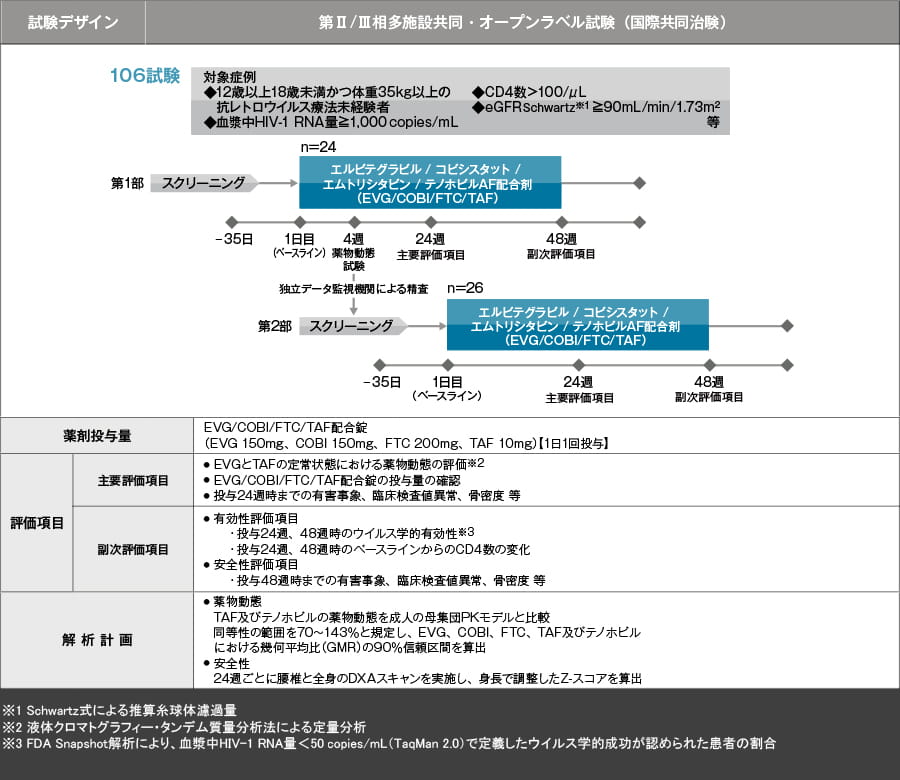
ウイルス学的効果:FDA Snapshot解析(24週、48週【副次評価項目】)
投与24週及び48週の血漿中HIV-RNA量を50 copies/mL未満に維持していたウイルス学的有効性が認められた患者の比率は、それぞれ90%、92%でした。
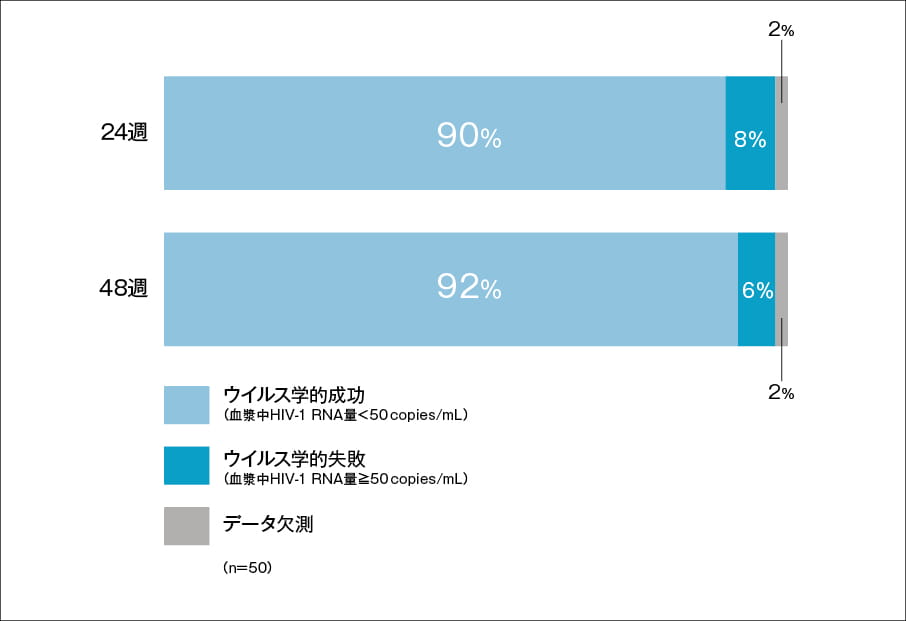
有害事象
投与48週までの試験期間中に認められた主な有害事象を以下に示します。 全50例中、有害事象は42例(84%)、副作用は18例(36%)に認められました。重篤な副作用は、視力障害/中間部ブドウ膜炎1例が認められました。
5%以上発現した有害事象(48週【副次評価項目】)
【用法・用量】
通常、成人及び12歳以上かつ体重35kg以上の小児には、以下の用法・用量で経口投与する。投与に際しては、必ず他の抗HIV薬と併用すること。
1.リトナビル又はコビシスタットと併用する場合は、デシコビ配合錠LT(エムトリシタビンとして200mg及びテノホビル アラフェナミドとして10mgを含有)を1日1回1錠経口投与する。
2.リトナビル又はコビシスタットと併用しない場合は、デシコビ配合錠HT(エムトリシタビンとして200mg及びテノホビル アラフェナミドとして25mgを含有)を1日1回1錠経口投与する。
【使用上の注意】(抜粋)
7.小児等への投与
低出生体重児、新生児、乳児、幼児、12歳未満又は体重35kg未満の小児に対する安全性は確立していない。







