本剤の「警告・禁忌を含む使用上の注意」等については
注意事項等情報(電子化された添付文書)をご参照ください。
C型非代償性肝硬変患者を対象とした海外第3相臨床試験(ASTRAL-4:海外データ)
エプクルーサ配合錠を1日1回1錠、12週間服用することで、C型非代償性肝硬変患者さんの83.3%がSVR12を達成しました。また、90例中73例(81.1%)に有害事象が認められました。
試験概要
| 目的 | Child-Pugh(CP)分類BのC型非代償性肝硬変を有する患者を対象にリバビリン(RBV)併用下又は非併用下におけるエプクルーサ配合錠投与の有効性と安全性を検討する。 |
|---|---|
| 対象 | CP-BのC型非代償性肝硬変を有する患者267例。 |
| 試験デザイン | 多施設共同、無作為化、非盲検、並行群間比較試験。 HCVジェノタイプ(1、2、3、4、5、6及び未確定)による層別ランダム化を実施した。 |
| 方法 | 対象をエプクルーサ配合錠12週間投与群、及び24週間投与群※又はエプクルーサ配合錠+RBV12週間投与群※に無作為に割り付け、経口投与を行った[エプクルーサ配合錠(ソホスブビル/ベルパタスビル:400mg/100mg)は1日1回、RBVは1,000又は1,200mg(体重に基づいた1日用量)を分割投与]。 |
| 主要評価項目 | SVR12率[投与終了から12週間後のHCV RNA量が定量下限(LLOQ)†未満を達成した患者割合]、安全性。 |
| 副次評価項目 | SVR4率、SVR24率、試験治療下の来院時ごとのウイルス陰性化率¶、HCV RNAの絶対量及びベースラインからの変化量、SVR12達成及び非達成例におけるCPスコア及びMELDスコアの変化、ウイルス学的転帰。 |
| 解析計画 | 主要評価項目はFull Analysis Set(FAS)において、Clopper-Pearson法に基づく正確な両側95%信頼区間(CI)を全ての投与群のSVR12率について算出した。各投与群のSVR12率を、有意水準を0.0167とする両側正確1標本二項検定により、推定される自然消失率1%と比較検討した。統計仮説は両側1標本二項検定により検証した。背景因子別のサブグループ解析は、HCVジェノタイプ/サブタイプ、MELDスコア15未満と15以上について実施することにした。 |
SVR:
sustained virologic response(持続的ウイルス陰性化)
†
定量下限(LLOQ):本試験のHCV RNA量の定量にはCOBAS® AmpliPrep / COBAS® TaqMan® HCV Quantitative Test
v2.0を用い、本分析法の定量下限(LLOQ)は15IU/mLでした。
¶
HCV RNA < LLOQを達成した患者割合。
◆ C型非代償性肝硬変を有する患者を対象とした海外第3相臨床試験(ASTRAL-4:海外データ):試験デザイン
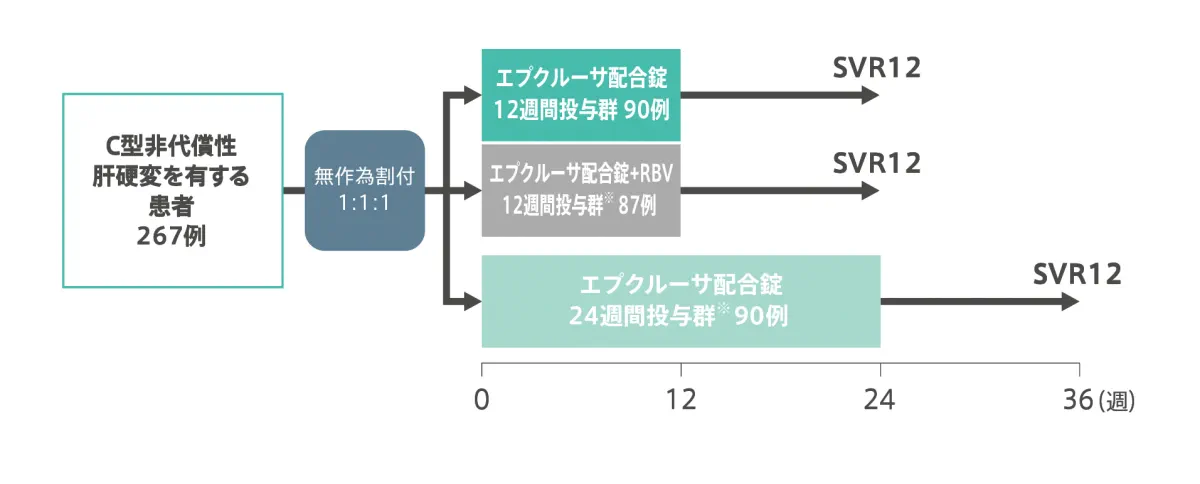
- C型非代償性肝硬変における本剤の24週間投与及び本剤とリバビリンとの併用は国内未承認。以降は、承認を受けた用法・用量の成績のみを紹介しています。
社内資料:承認時評価資料(海外第3相臨床試験:GS-US-342-1137)
Curry MP, et al. N Engl J Med. 373(27): 2618-2628, 2015
利益相反:
本研究はギリアド・サイエンシズ, Inc.の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。本論文の著者には、ギリアド・サイエンシズ,
Inc.より講演料等を受領した者が含まれる。
【用法・用量】(抜粋)
〈C型非代償性肝硬変におけるウイルス血症の改善〉
通常、成人には、1日1回1錠(ソホスブビルとして400mg及びベルパタスビルとして100mg)を12週間経口投与する。
リバビリンの本邦における承認用量は、1日投与量で体重に応じて600〜1,000mgです。
患者背景
患者背景
| エプクルーサ配合錠12週間投与群 (n=90) |
|||
|---|---|---|---|
| 年齢中央値(範囲) | 59歳(42-73) | ||
| 男性 | 57例(63.3%) | ||
| BMI(平均値±標準偏差),kg/m2 | 31.2±7.41 | ||
| IL28B CC 遺伝子型 | 20例(22.2%) | ||
| HCV RNA量(平均値±標準偏差),(範囲), log10 IU/mL | 6.0 ± 0.54(3.7-7.2) | ||
| eGFR(平均値±標準偏差), mL/min | 88.8 ± 27.50 | ||
| 前治療歴※1 | なし | 32例(35.6%) | |
| あり | 58例(64.4%) | ||
| CPスコア | ≦ 6※2 | 3例(3.3%) | |
| 7 | 36例(40.0%) | ||
| 8 | 31例(34.4%) | ||
| 9 | 19例(21.1%) | ||
| 10※2 | 1例(1.1%) | ||
| MELDスコア* | < 10 | 36例(40.0%) | |
| 10-15 | 50例(55.6%) | ||
| 16-20 | 3例(3.3%) | ||
| 21-25 | 1例(1.1%) | ||
| ジェノタイプ | 1a | 50例(55.6%) | |
| 1b | 18例(20.0%) | ||
| 2 | 4例(4.4%) | ||
| 3 | 14例(15.6%) | ||
| 4 | 4例(4.4%) | ||
- 治療歴にはプロテアーゼ阻害剤、Peg-IFN+RBVが含まれました。
- スクリーニング時にCPスコアが7~9と判定されたが、ベースライン時に≦6又は10であった症例。
* 末期肝疾患モデル(Model for End Stage Liver Disease)スコア:末期肝疾患患者の病期分類で使用され、肝移植適応の判断や移植待機者の優先順位を数値化して判定することを目的として使用されています。通常、MELDスコア15以上で肝移植の適応となります。
社内資料:承認時評価資料(海外第3相臨床試験:GS-US-342-1137)
Curry MP, et al. N Engl J Med. 373(27): 2618-2628, 2015
利益相反:
本研究はギリアド・サイエンシズ, Inc.の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。本論文の著者には、ギリアド・サイエンシズ, Inc.より講演料等を受領した者が含まれる。
SVR12率(主要評価項目、サブグループ解析)
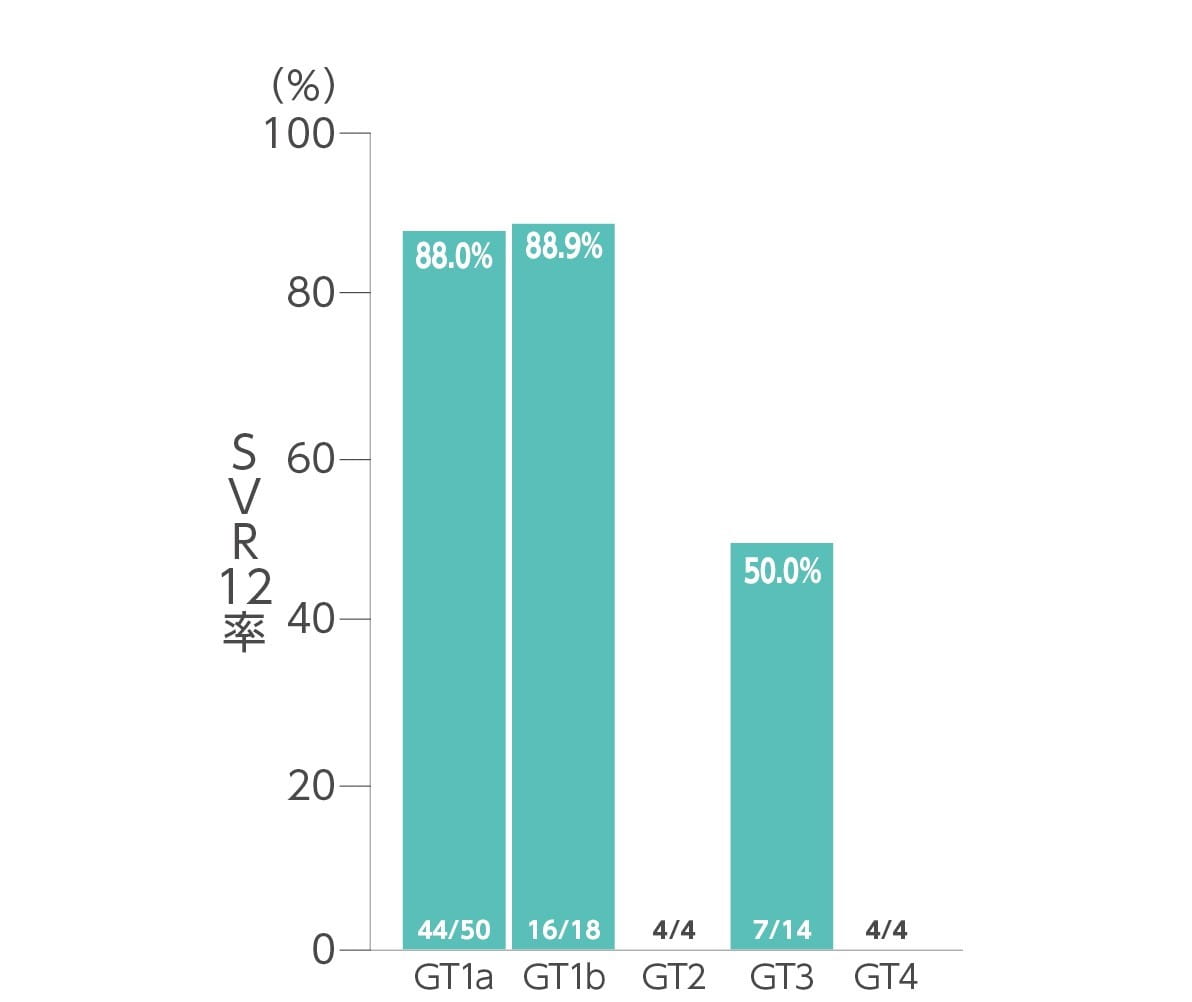
エプクルーサ配合錠12週間投与により患者全体の83.3%(75/90例)がSVR12[投与終了12週間後の持続的ウイルス陰性化]を達成しました(主要評価項目)。ジェノタイプ別SVR12率は、ジェノタイプ1aが88.0%(44/50例)、ジェノタイプ1bが88.9%(16/18例)、ジェノタイプ2が4/4例、ジェノタイプ3が50.0%(7/14例)、ジェノタイプ4が4/4例でした(サブグループ解析)。
◆ SVR12率※(主要評価項目)
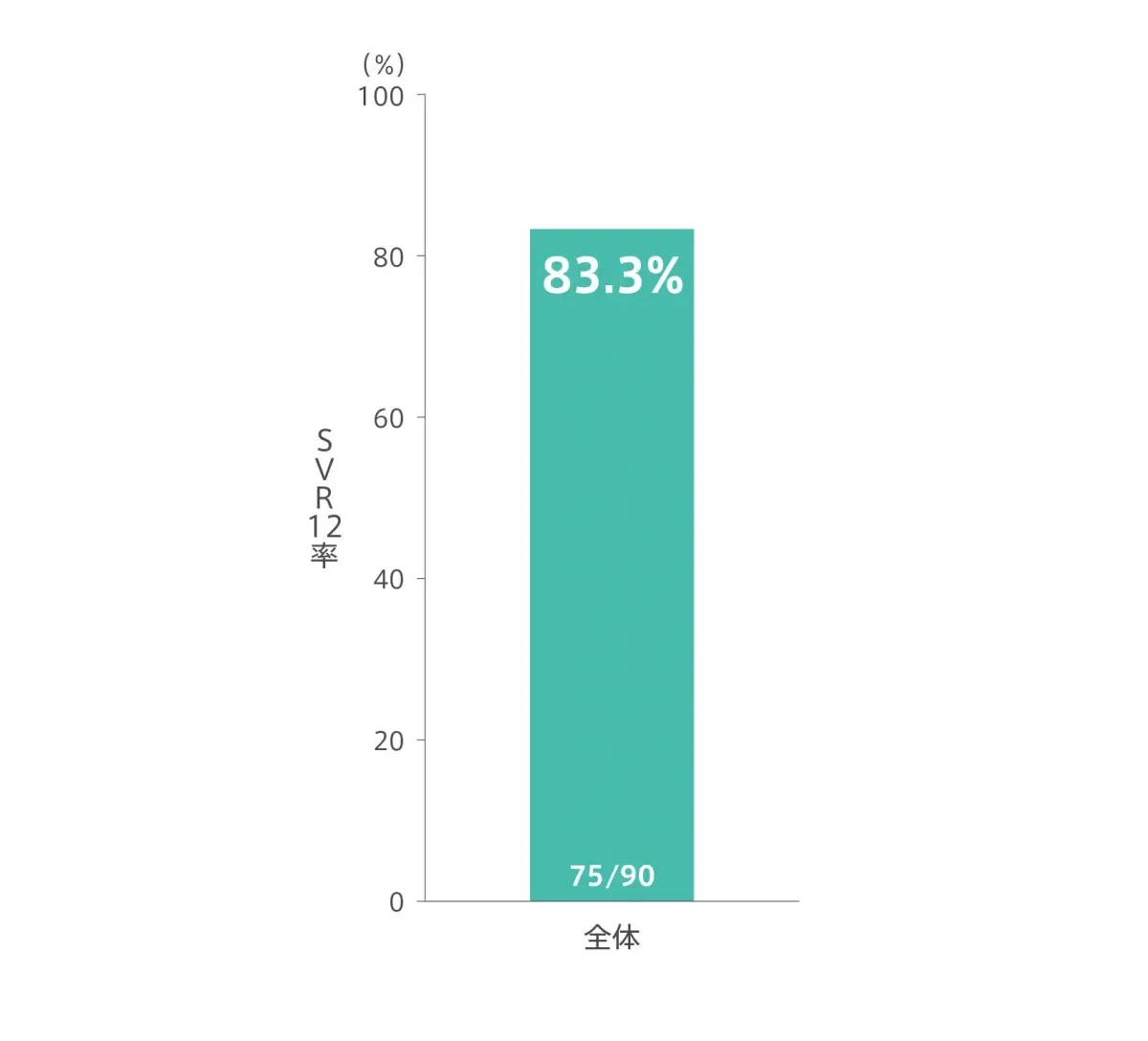
- 投与終了12週間後の持続的ウイルス陰性化率
◆ ジェノタイプ別SVR12率(サブグループ解析)
社内資料:承認時評価資料(海外第3相臨床試験:GS-US-342-1137)
Curry MP, et al. N Engl J Med. 373(27): 2618-2628, 2015
利益相反:
本研究はギリアド・サイエンシズ, Inc.の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。本論文の著者には、ギリアド・サイエンシズ,
Inc.より講演料等を受領した者が含まれる。
SVR24率(副次評価項目)
エプクルーサ配合錠12週間投与によりSVR12を達成した全例がSVR24を達成しました。
SVR12達成例におけるCP分類の変化(副次評価項目)【参考情報】
エプクルーサ配合錠12週間投与においてSVR12を達成した75例のうち、CP分類を評価した73例において、投与終了後12週時点で17例(23.3%)がCP-B→CP-A又はCP-C→CP-B になりました。ベースラインでCP-A又はCP-Bであった3例(4.1%)は、それぞれCP-B又はCP-Cになりました。その他の53例(72.6%)のCP分類は、ベースライン時と同じでした。
◆ SVR12達成例におけるCP分類の変化
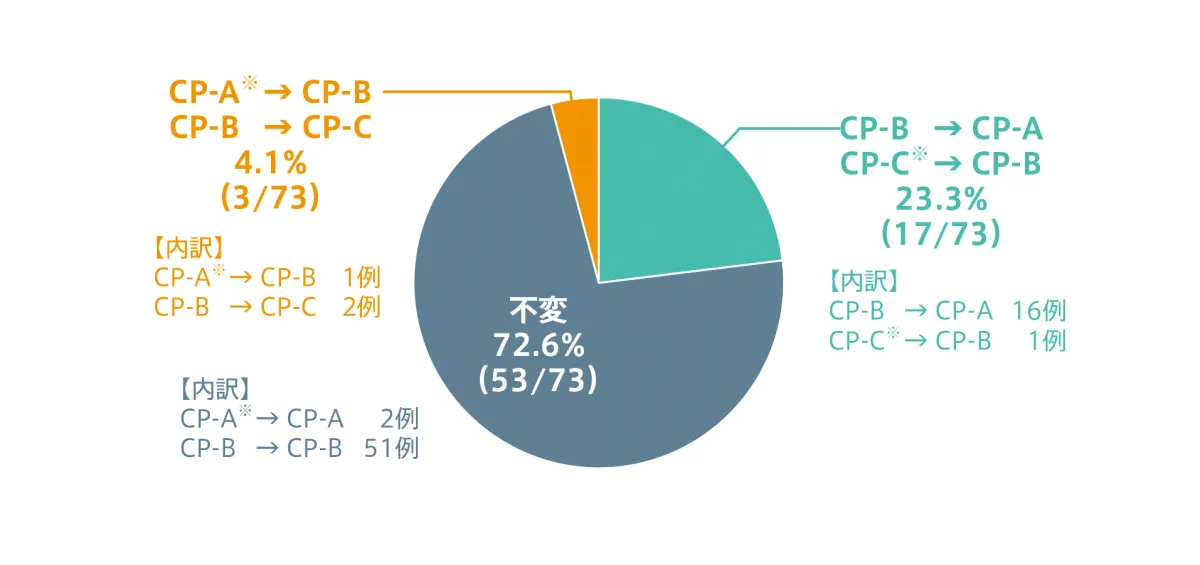
- スクリーニング時にCP-Bと判定されたが、ベースライン時にCP-A又はCP-Cであった症例。
社内資料:承認時評価資料(海外第3相臨床試験:GS-US-342-1137)
Curry MP, et al. N Engl J Med. 373(27): 2618-2628, 2015
利益相反:
本研究はギリアド・サイエンシズ, Inc.の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。本論文の著者には、ギリアド・サイエンシズ,
Inc.より講演料等を受領した者が含まれる。
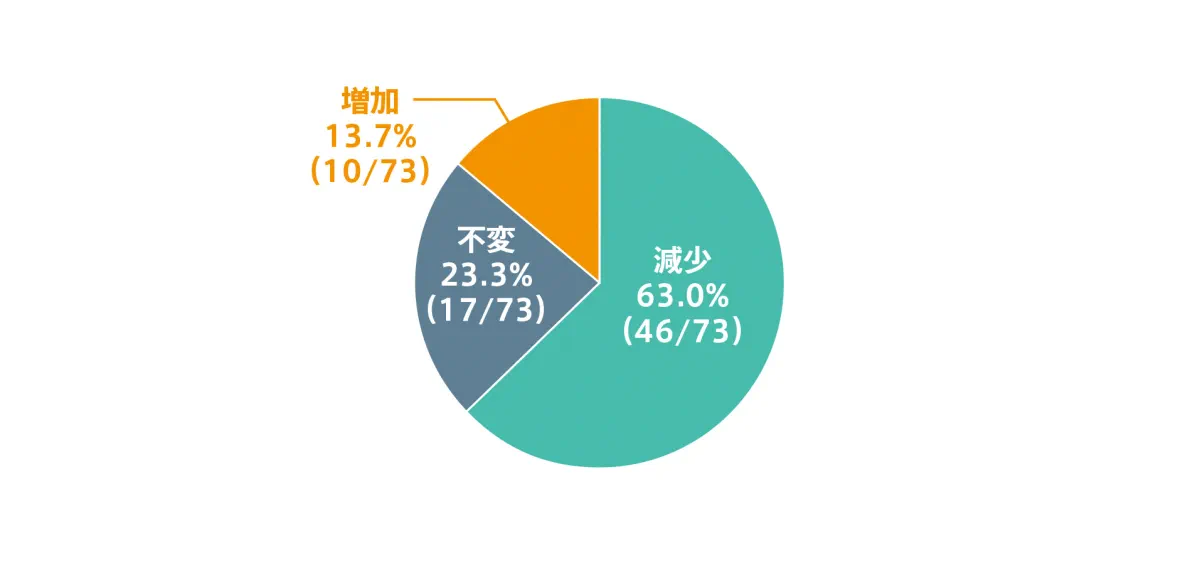
SVR12達成例におけるMELDスコアの変化(副次評価項目)【参考情報】
エプクルーサ配合錠12週間投与においてSVR12を達成した75例のうち、MELDスコアを評価した73例において、46例(63.0%)でMELDスコアが減少しました。
◆ SVR12達成例におけるMELDスコアの変化
社内資料:承認時評価資料(海外第3相臨床試験:GS-US-342-1137)
Curry MP, et al. N Engl J Med. 373(27): 2618-2628, 2015
利益相反:
本研究はギリアド・サイエンシズ, Inc.の資金提供および支援により行われた。本論文の著者には、ギリアド・サイエンシズ, Inc.の社員が含まれる。本論文の著者には、ギリアド・サイエンシズ,
Inc.より講演料等を受領した者が含まれる。
安全性(主要評価項目)
【有害事象発現状況】
C型非代償性肝硬変患者を対象にエプクルーサ配合錠を12週間投与した海外第3相臨床試験において、90例中73例(81.1%)に有害事象が認められました。主な有害事象は、疲労23例(25.6%)、頭痛23例(25.6%)、悪心22例(24.4%)でした。
エプクルーサ配合錠12週間投与群において、治療下又は治療下外で3例(肝不全、敗血症及び多臓器不全、敗血症性ショック各1例)の死亡が認められました。また17例(胃腸出血3例、肝性脳症、悪心各2例、敗血症、低ナトリウム血症、貧血、蜂巣炎、胃静脈瘤出血、痙攣発作、上部消化管出血、骨膿瘍、大腸炎、うつ病、びまん性大細胞型B細胞性リンパ腫、胃潰瘍、ヘルニア、鉄欠乏性貧血、関節脱臼、限局性感染、マロリー・ワイス症候群、精神状態変化、心筋梗塞、骨髄炎、門脈血栓症、小腸閉塞、嘔吐各1例)に重篤な有害事象が認められました。投与中止に至った有害事象は1例(びまん性大細胞型B細胞性リンパ腫)に認められました。




