ジェノタイプ1のC型慢性肝炎患者又はC型代償性肝硬変患者を対象とした臨床成績(国内第3相臨床試験)
ハーボニー配合錠は、治療歴、代償性肝硬変の有無、年齢及び投与前のNS5A耐性関連変異の有無にかかわらず、SVR12率は100%でした。
試験概要
| 目的 | ジェノタイプ1の日本人C型慢性肝炎患者におけるリバビリン(RBV)併用又は非併用下でのハーボニー配合錠の有効性・安全性を検討する。 |
| 対象 | 未治療又は前治療のある※1ジェノタイプ1(1a及び1b)のC型慢性肝炎患者318例(C型代償性肝硬変※2患者72例を含む) ※1 ペグインターフェロン、RBV 及びプロテアーゼ阻害剤による併用療法を含む。 ※2 肝硬変の判定基準には、肝生検又はFibroscanの結果(>12.5kPa)を用いた。 |
| 試験方法 | 多施設共同無作為化非盲検試験 |
| 投与方法 | ハーボニー配合錠単独又はハーボニー配合錠とRBVを12週間投与した。ハーボニー配合錠は1日1回1錠、RBVは1日2回(600、800又は1,000mg/日)経口投与した。 |
| 主要評価項目 | SVR12率[投与終了から12週間後のHCV RNA量が定量下限値(25 IU/mL)未満を達成した患者の割合]、安全性 |
| 副次評価項目 | SVR4率及びSVR24率、薬剤耐性、血中HCV RNA動態、ウイルス陰性化率、背景因子別のサブグループ解析等 |
| その他の有効性評価項目 | ALTの正常化 |
| 解析計画 | 主要評価項目はFull Analysis Set(FAS)を基にしたreanalysis population(再解析集団)にて解析を実施することとした。背景因子別のサブグループ解析は、前治療(なし/あり)、年齢(65歳以上/未満)、性別(男性/女性)、ベースラインのBMI(25kg/m2以上/未満)、代償性肝硬変(なし/あり)、前治療への反応(無効/再燃/ブレイクスルー/インターフェロン不耐容)、インターフェロン適格性(インターフェロン適格/インターフェロン不適格)、ベースラインのHCV RNA量(800,000 IU/mL以上/未満)、ベースラインのALT値(正常範囲上限の1.5倍超/以下)、IL28B(CC/non-CC)、試験薬のアドヒアランス(80%以上/未満)等について、副次評価項目として実施することとした。ベースラインでのNS5A耐性関連変異(なし/あり)及びNS3/4Aプロテアーゼ阻害剤を含む3剤併用療法無効例に対するサブグループ解析については、審査当局の照会に応じて試験終了後に実施した。 |
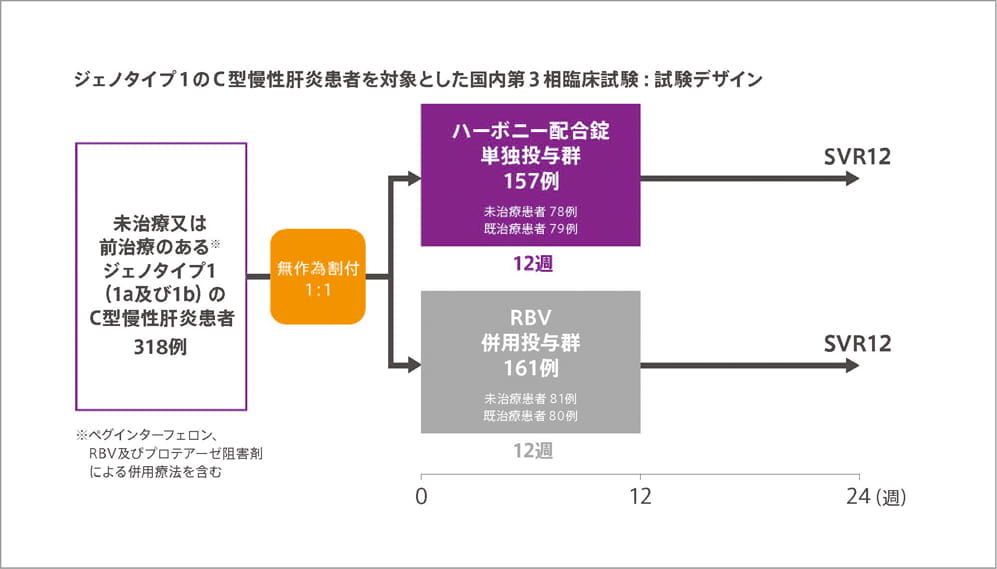
本剤は、本剤単独投与群の成績をもとに承認されました。そのため本剤とリバビリンの併用群の試験結果は記載しておりません。
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-337-0113)
患者背景
| 未治療患者(n=78) | 前治療のある患者(n=79) | |
|---|---|---|
| 年齢中央値(範囲) | 60歳(34~80) | 63歳(43~75) |
| ≧65歳 | 22例(28.2%) | 35例(44.3%) |
| 男性 | 31例(39.7%) | 29例(36.7%) |
| BMI(平均値±標準偏差) | 22.7±3.33kg/m2 | 24.0±3.82kg/m2 |
| IL28B CC遺伝子型※1 | 50例(64.1%) | 31例(39.2%) |
| HCV RNA量(平均値±標準偏差)(範囲) | 6.6±0.48 log10IU/mL(4.7〜7.6) | 6.6±0.56 log10IU/mL(4.9〜7.4) |
| HCV RNA≧5 log10 IU/mL | 77例(98.7%) | 78例(98.7%) |
| ALT値中央値(Q1※2〜Q3※3) | 40 U/L(31〜62) | 43 U/L(32〜75) |
| 代償性肝硬変 | 13例(16.7%) | 27例(34.2%) |
| 投与前におけるNS5A耐性関連変異あり | 21例(26.9%) | 20例(25.3%) |
| インターフェロン適格 | 74例(94.9%) | - |
| インターフェロン不適格 | 4例(5.1%) | - |
| 前治療無効 | - | 25例(31.6%) |
| 前治療再燃/ブレイクスルー | - | 39例(49.4%) |
| インターフェロン不耐容 | - | 15例(19.0%) |
※1
IL28B領域の一塩基多型(SNPs)の解析にあたり、本試験においては、rs12979860の解析によりSNPsのメジャーアリル(CC)もしくはマイナーアリル(CT、TT)を同定している。
※2 25 パーセンタイル
※3 75 パーセンタイル
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-337-0113)
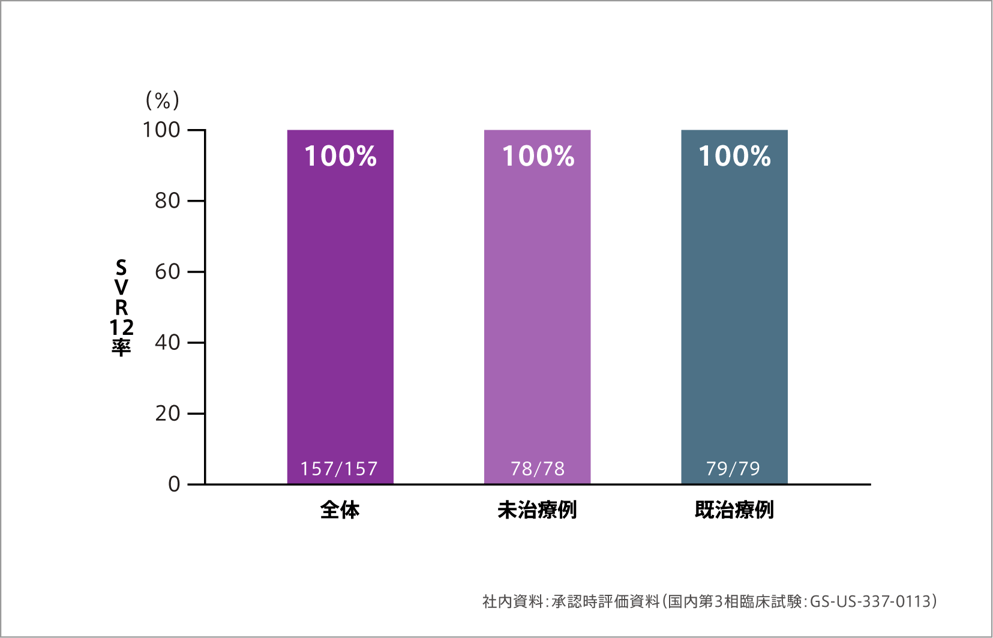
主要評価項目:SVR12率[ジェノタイプ1]
ハーボニー配合錠を1日1回、12週間にわたり経口投与した結果、主要評価項目である投与終了12週間後のウイルス持続陰性化率(SVR12率)は、前治療の有無にかかわらず100%を達成しました。
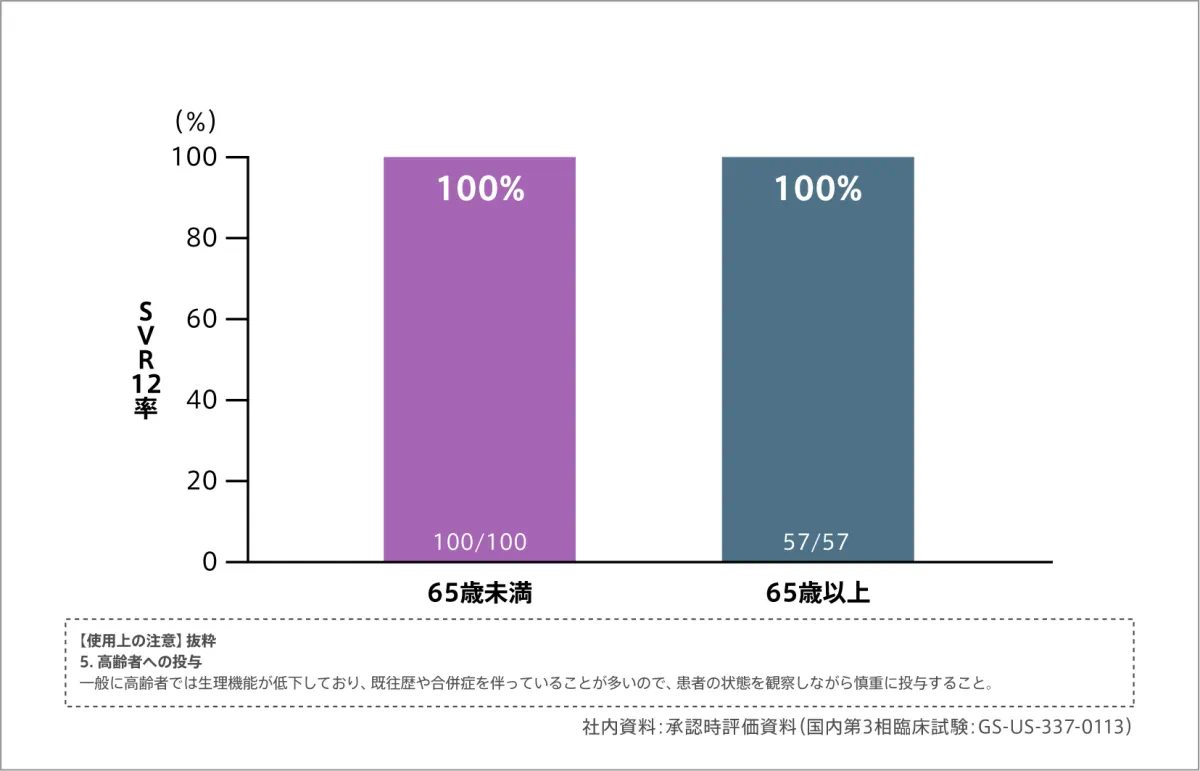
サブグループ解析:背景因子別SVR12率[ジェノタイプ1]
背景因子別SVR12率は以下の通りです。
(1)年齢別
(2)性別
![サブグループ解析:背景因子別SVR12率[ジェノタイプ1] 性別](/-/media/Images/GStation/product/hcv/harvoni/clinical/efficacy1/harvoni_clinical_efficacy1_003.png?h=569&iar=0&w=886&hash=418BEAC449F9F6018500D41EBFC7382E)
(3)前治療の再燃例・無効例別
![サブグループ解析:背景因子別SVR12率[ジェノタイプ1] 前治療の再燃例・無効例別](/-/media/Images/GStation/product/hcv/harvoni/clinical/efficacy1/harvoni_clinical_efficacy1_004.png?h=569&iar=0&w=885&hash=E7CA4C9EBDE33EBEDBED80F17A8883EE)
(4)代償性肝硬変の有無別
![サブグループ解析:背景因子別SVR12率[ジェノタイプ1] 代償性肝硬変の有無別](/-/media/Images/GStation/product/hcv/harvoni/clinical/efficacy1/harvoni_clinical_efficacy1_005.png?h=569&iar=0&w=885&hash=01700EAFF42AA4721D47D4989725C5A3)
(5)NS3/4Aプロテアーゼ阻害剤を含む3剤併用療法無効例
![サブグループ解析:背景因子別SVR12率[ジェノタイプ1] NS3/4Aプロテアーゼ阻害剤を含む3剤併用療法無効例](/-/media/Images/GStation/product/hcv/harvoni/clinical/efficacy1/harvoni_clinical_efficacy1_006.png?h=569&iar=0&w=886&hash=8F6977B076F151DA3C41F27FE906B404)
(6)投与前におけるNS5A耐性関連変異の有無別
![サブグループ解析:背景因子別SVR12率[ジェノタイプ1] 投与前におけるNS5A耐性関連変異の有無別](/-/media/Images/GStation/product/hcv/harvoni/clinical/efficacy1/harvoni_clinical_efficacy1_007.jpg?h=569&iar=0&w=886&hash=9A8AD263F0CB2255CFAE3AF8C1A79573)
副次評価項目:HCV RNA量の推移/ウイルス陰性化率[ジェノタイプ1]
ハーボニー配合錠は、血中HCV RNA量を速やかに低下させ、投与4週までに全例でウイルスを陰性化させました。
HCV RNA量のベースラインからの変化量の推移及びウイルス陰性化率
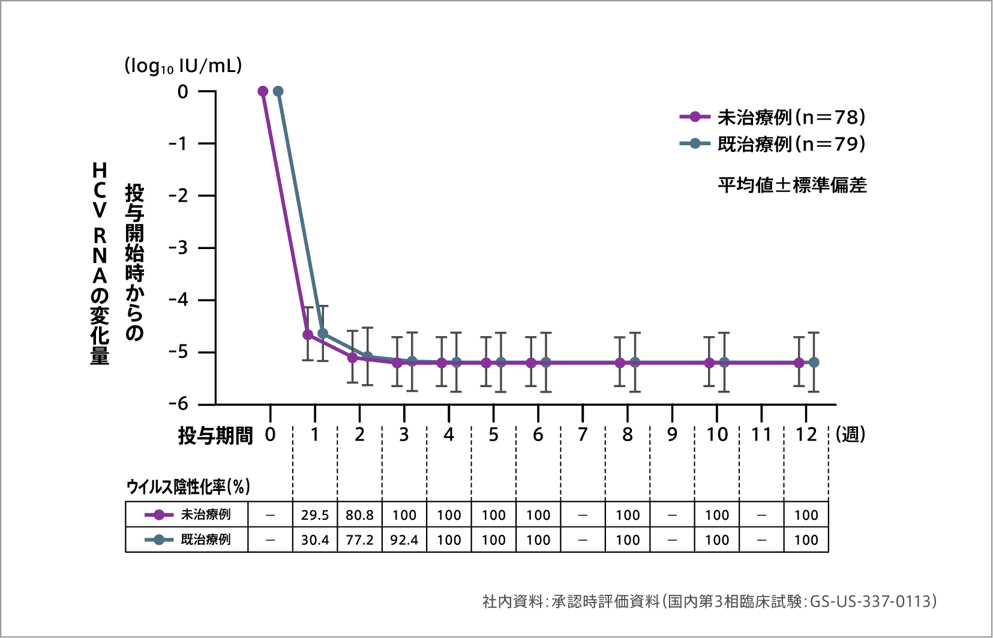
治療期間終了時(12週)でのHCV RNA量のベースラインからの変化量の平均値(標準偏差)は、-5.20(0.476)~ -5.19(0.563)log10IU/mL でした。
その他の有効性評価項目:ALTへの影響[ジェノタイプ1](参考情報)
ALT値の推移
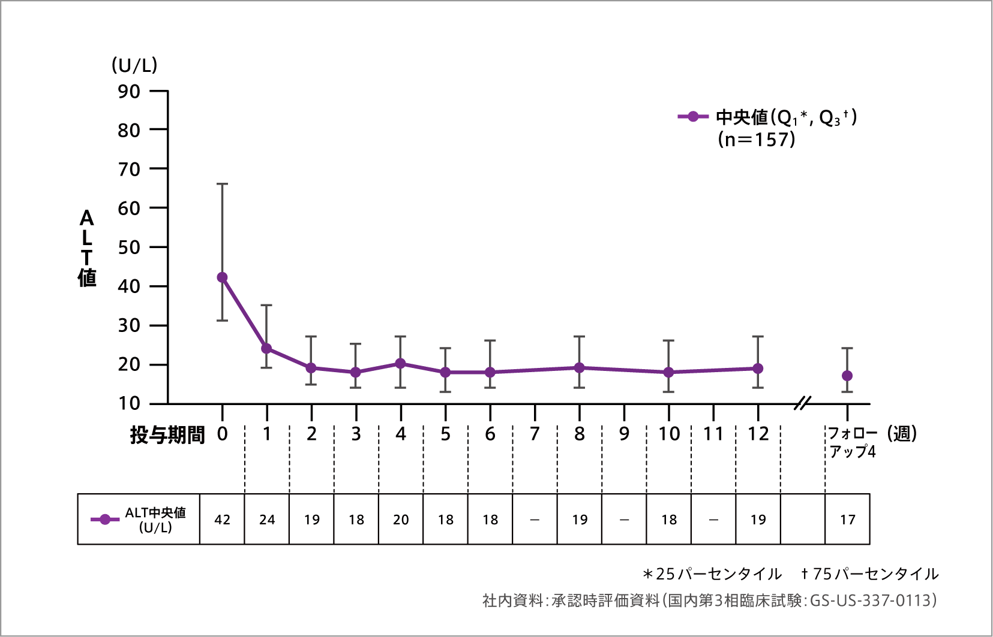
投与開始時に56.1%(88/157例)でアラニン・アミノトランスフェラーゼ(ALT)が正常範囲上限を上回っていましたが、投与期間中のウイルス増殖の抑制と一致してALTの正常化がみられ、投与終了時までに83.5%(71/85例)のALTが正常化しました。
副次評価項目:ウイルス学的転帰[ジェノタイプ1]
本試験のハーボニー配合錠投与期間中から投与終了後24週において、ウイルス学的治療不成功(ブレイクスルー例及び再燃例)は認められませんでした。
国内第3相臨床試験におけるウイルス学的転帰(n=157)
| 投与期間中 | 投与終了後12週 | 投与終了後24週 | |
|---|---|---|---|
| ブレイクスルー例又は再燃例 | 0 | 0 | 0 |
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-337-0113)
* HCVジェノタイプ1~6のレプリコン細胞を用いたソホスブビルのin vitro耐性発現試験において、NS5B領域のS282T変異が認められています。
社内資料:(ソホスブビルの耐性発現に関する試験:PC-334-2010)
安全性[ジェノタイプ1]
(1)安全性のまとめ
ハーボニー配合錠単独投与群における安全性のまとめ
| ハーボニー配合錠(n=157) | ||
|---|---|---|
| 安全性 | 有害事象 | 104(66.2%) |
| Grade3/4有害事象 | 3(1.9%) | |
| 重篤な有害事象(SAE) | 2(1.3%)* | |
| 治験薬と関連のあるSAE | 0 | |
| 有害事象による投与中止 | 0 | |
| 有害事象による用量調節又は休薬 | 1(0.6%) | |
| 死亡 | 0 | |
| 臨床検査値異常 | Grade3臨床検査値異常‡ | 12(7.6%) |
| ヘモグロビン<10g/dL | 4(2.5%) | |
| ヘモグロビン<8.5g/dL | 1(0.6%)§ |
* SAE(ハーボニー配合錠単独投与群):肝細胞癌、食道静脈瘤出血
‡ Grade4の臨床検査値異常は認められなかった
§ 食道静脈瘤出血の被験者
国内第3相臨床試験において、ハーボニー配合錠の単独12週投与は、良好な安全性と忍容性を示しました。
ハーボニー配合錠単独投与群において、有害事象による投与中止例は認められませんでした。
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-337-0113)
(2)有害事象
ハーボニー配合錠単独投与群において、Grade3以上の有害事象は、3例に認められました。
| Grade3又は4の有害事象 | ハーボニー配合錠12週 | 合計(n=157) | |
| 65歳未満(n=100) | 65歳以上(n=57) | ||
| 全体 | 1(1.0%) | 2(3.5%) | 3(1.9%) |
| Grade3 | |||
| リパーゼ増加 | 1(1.0%) | 0 | 1(0.6%) |
| 食道静脈瘤出血 | 0 | 1(1.8%) | 1(0.6%) |
| Grade4 | |||
| 肝細胞癌 | 0 | 1(1.8%) | 1(0.6%) |
9. 特定の背景を有する患者に関する注意(抜粋)
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下しており、既往歴や合併症を伴っていることが多くみられる。
社内資料:承認時評価資料(国内第3相臨床試験:GS-US-337-0113)
(3)副作用
ジェノタイプ1のC型慢性肝炎患者又はC型代償性肝硬変患者を対象にハーボニー配合錠の単独投与における有効性及び安全性を評価した国内第3相臨床試験において、157例中34例(21.7%)に副作用が認められました。
主な副作用は、そう痒症5例(3.2%)、悪心及び口内炎各4例(2.5%)等でした。(承認時)
なお、ハーボニー配合錠単独投与群において、有害事象による投与中止例は認められませんでした。
ジェノタイプ1のC型慢性肝炎患者を対象とした臨床成績(国内第3相臨床試験)
| 安全性評価対象例数 | 157例 |
|---|---|
| 副作用発現症例数 | 34例 |
| 副作用発現症例率 | 21.7% |
| 副作用名 | 副作用発現例数(%) |
|---|---|
| 血液およびリンパ系障害 | 2(1.3%) |
| 貧血 | 2(1.3%) |
| 心臓障害 | 1(0.6%) |
| 心室性期外収縮 | 1(0.6%) |
| 眼障害 | 2(1.3%) |
| 結膜出血 | 1(0.6%) |
| アレルギー性結膜炎 | 1(0.6%) |
| 硝子体浮遊物 | 1(0.6%) |
| 胃腸障害 | 14(8.9%) |
| 悪心 | 4(2.5%) |
| 口内炎 | 4(2.5%) |
| 便秘 | 3(1.9%) |
| 腹部不快感 | 3(1.9%) |
| 軟便 | 1(0.6%) |
| 口唇炎 | 1(0.6%) |
| 下痢 | 1(0.6%) |
| 腹部膨満 | 1(0.6%) |
| 歯周病 | 1(0.6%) |
| 一般・全身障害および 投与部位の状態 |
4(2.5%) |
| 倦怠感 | 1(0.6%) |
| 末梢性浮腫 | 1(0.6%) |
| 発熱 | 1(0.6%) |
| 口渇 | 1(0.6%) |
| 副作用名 | 副作用発現例数(%) |
|---|---|
| 感染症および寄生虫症 | 1(0.6%) |
| 毛包炎 | 1(0.6%) |
| 臨床検査 | 1(0.6%) |
| リパーゼ増加 | 1(0.6%) |
| 代謝および栄養障害 | 1(0.6%) |
| 高コレステロール血症 | 1(0.6%) |
| 神経系障害 | 3(1.9%) |
| 頭痛 | 3(1.9%) |
| 精神障害 | 1(0.6%) |
| 不眠症 | 1(0.6%) |
| 呼吸器、胸郭および 縦隔障害 |
1(0.6%) |
| 口腔咽頭痛 | 1(0.6%) |
| 皮膚および皮下組織障害 | 10(6.4%) |
| そう痒症 | 5(3.2%) |
| 発疹 | 2(1.3%) |
| 湿疹 | 1(0.6%) |
| 皮膚反応 | 1(0.6%) |
| 脱毛症 | 1(0.6%) |
MedDRA version 17.0で集計
承認時社内集計




