抗HIV薬による治療経験がありウイルス学的に抑制されているHIV-1感染症患者に対する試験(1844試験および1878試験)でビクタルビ配合錠に切り替えた群において、ベースライン時の耐性変異が次世代シーケンシング(NGS)法を用いて改めて解析されました
- RT(逆転写酵素)領域の検査が行われた543例において、M184V/Iは10%(54例)に見つかりました
- 見つかったM184V/I の72%(39例)で他のNRTIおよびNNRTI関連一次変異が重複していました
- M184V/Iが発見された54例のうち、96.3%(52例)は48週時に血漿中HIV-1 RNA量 50 copies/mL未満を達成していました
| 目的 | ビクタルビ配合錠治療によるウイルス学的成功率を、耐性変異の種類別に検討する。 |
|---|---|
| 方法 | 2件の臨床試験(1844試験および1878試験)において、DTG+ABC/3TCまたはABC/DTG/3TCからビクタルビ配合錠に切り替えて治療を行ったHIV-1感染症患者570例のベースライン(切り替え前)の全血保存検体を用いて、次世代シーケンシング(NGS)法によりプロウイルスDNAをもとに後ろ向きに耐性変異を解析した。検出された耐性変異の種類別に、ウイルス学的成功率(ビクタルビ配合錠に切り替え48週時点においてHIV-1 RNA量 50 copies/mL未満)を評価した。 |
ベースライン時における耐性変異とそれらの耐性変異を保有する患者の48週時のウイルス学的転帰(海外第Ⅲ相臨床試験1844試験および1878試験)(海外データ)
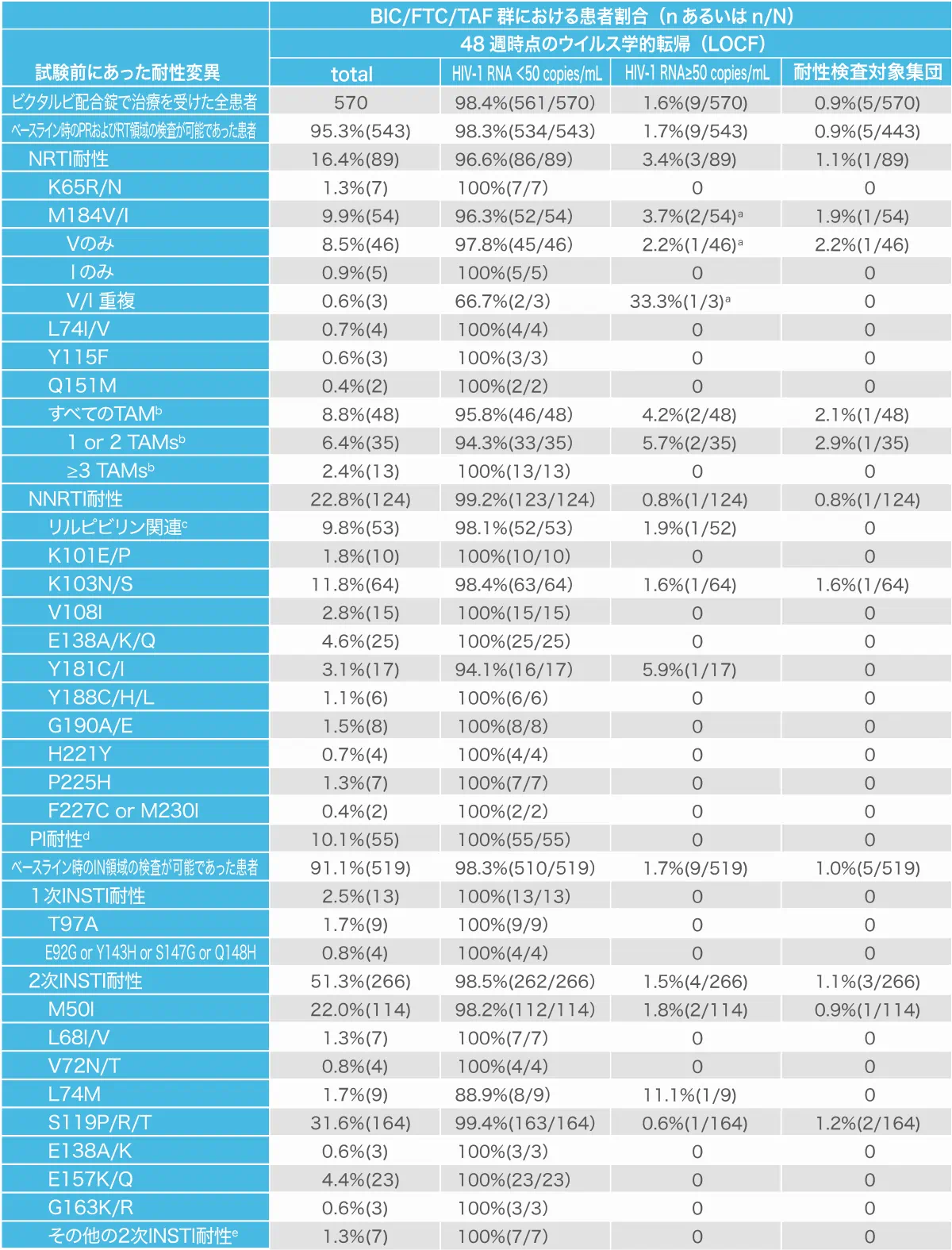
a:M184Vを保有していた1名のウイルス学的失敗はアドヒアランス不良によるものと考えられ(錠数カウントで76%および血漿中のビクテグラビル濃度が検出されなかった)、当患者には追加の耐性変異は発現しなかった。M184Vを保有していたもう1名はアドヒアランス不良(錠数カウントで71%)で試験を早期中止し、最終の検査時のHIV-1
RNA量は61
copies/mLであった(耐性検査の基準には該当せず)。
b:TAM(チミジンアナログ変異)はRT領域のM41L、D67N、K70R、L210W、T215Y/F、K219E/Q/Rを指す。内訳はM41L(n=23)、D67N(n=13)、K70R(n=20)、L210W(n=9)、T215F/Y(n=16)、K219E/N/Q/R(n=13)であった。
c:次の変異を1つもしくは複数保有する場合:L100I、K101E/P、E138A/G/K/Q/R、V179L、Y181C/I/V、Y188L、H221Y、F227C、M320I/L
d:内訳はM46I/L(n=22)、L90M(n=13)、D30N(n=9)、V82A/L/T(n=7)、I84V(n=5)、I47V(n=2)、N83D(n=2)、N88S(n=2)、V32I(n=1)、I50V(n=1)、I54L(n=1)、Q58E(n=1)、L76V(n=1)であった。
e:内訳はF121C(n=2)、A128T(n=2)、G140S(n=2)、S153A(n=1)であった。
Andreatta K, et al.: J Antimicrob Chemother. 2019; 74(12):
3555.
〔利益相反〕本試験はギリアド・サイエンシズ社より支援を受けている。著者はギリアド・サイエンシズ社の社員である。
抗HIV薬による治療経験がないHIV-1感染症患者を対象とした試験における144週の観察の結果、ビクタルビ配合錠の成分に対する新たな耐性変異の発現は認められませんでした
抗HIV薬による治療経験がないHIV-1感染症患者を対象とした1489試験、1490試験における耐性検査対象例と耐性変異発現例(海外データ)
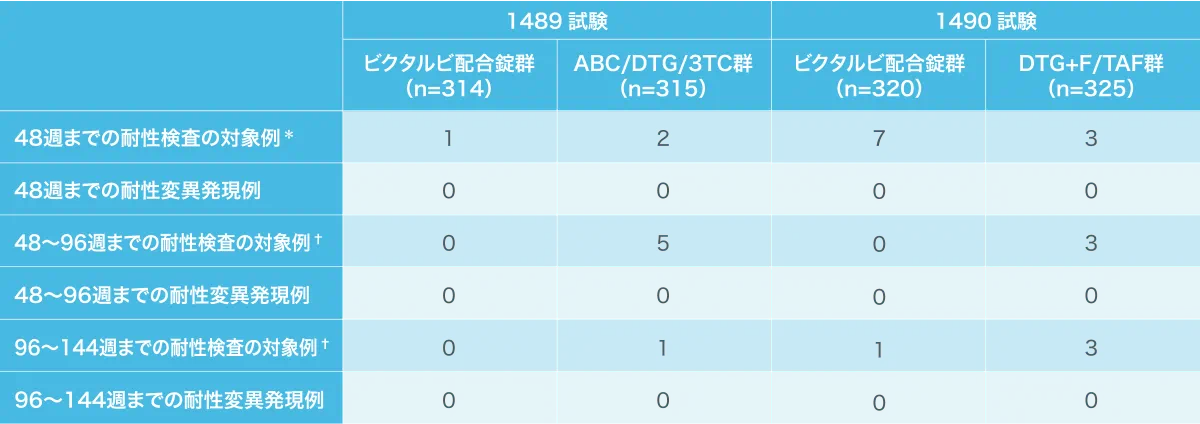
ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン、F:エムトリシタビン、TAF:テノホビル アラフェナミド
*:ウイルス学的失敗と判定された時点、投与48週後または早期に本剤の投与を中止した時点のHIV-1 RNA量が200
copies/mL以上であった患者を対象に遺伝子型および表現型解析を行った。
†:2回の来院で連続してHIV-1 RNA量が200
copies/mL以上であった患者、あるいは48週、96週、144週、8週以降の最後の来院においてHIV-1 RNA量が200 copies/mL以上であり、その後治療を受けながらもHIV-1
RNA量が50 copies/mL未満にならなかった患者を対象に遺伝子型および表現型解析を行った。
Gallant J, et al.: Lancet 2017; 390: 2063.; Wohl DA, et al.:
Lancet HIV 2019; 6(6): e355.; Sax PE, et al.: Lancet 2017; 390: 2073.; Stellbrink HJ, et al.: Lancet
HIV 2019; 6(6): e364.; Orkin C, et al.: Lancet HIV 2020; 7: e389.
〔利益相反〕上記試験はギリアド・サイエンシズ社より支援を受けている。著者にギリアド・サイエンシズ社より支援を受けている者が含まれる。
抗HIV薬による治療経験がありウイルス学的に抑制されているHIV-1感染症患者を対象とした1878試験、4030試験における耐性変異発現例(海外データ)
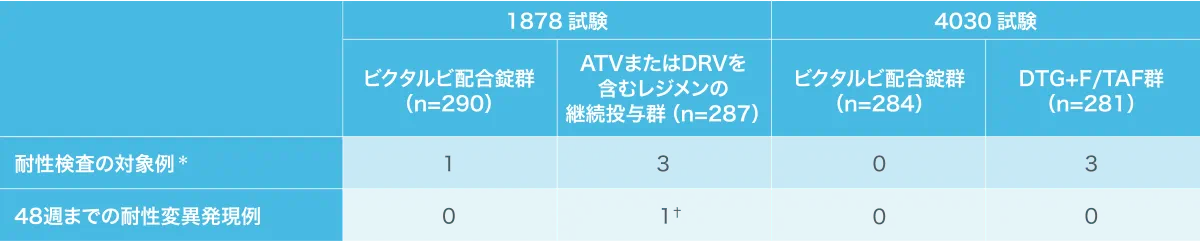
ATV:アタザナビル、DRV:ダルナビル、DTG:ドルテグラビル、F:エムトリシタビン、TAF:テノホビル アラフェナミド
*:ウイルス学的失敗と判定された時点、投与48週後または早期に本剤の投与を中止した時点のHIV-1 RNA量が200 copies/mL以上であった患者を対象に遺伝子型
および表現型解析を行った。
†:投与開始4週時にABC耐性変異(野生株との混合で逆転写酵素にL74V部位変異を確認)が発現した。
Daar ES, et al.: Lancet HIV 2018; 5(7): e347.; Sax PE, et
al.: Clin Infec Dis 2020; ciaa988. Online ahead of print.
〔利益相反〕上記試験はギリアド・サイエンシズ社より支援を受けている。
著者にギリアド・サイエンシズ社より支援を受けている者が含まれる。
5. 効能又は効果に関連する注意(抜粋)
5.2 本剤による治療に当たっては、患者の治療歴及び可能な場合には薬剤耐性検査(遺伝子型解析あるいは表現型解析)を参考にすること。







