ゲンボイヤ配合錠の特性
-
ゲンボイヤ配合錠は、エルビテグラビル、コビシスタット、エムトリシタビン及びテノホビル アラフェナミドフマル酸塩の4成分を含有する配合錠です。
-
テノホビル アラフェナミド投与時の血漿中テノホビル曝露量(AUC)は、テノホビル ジソプロキシルフマル酸塩投与時に比べ約90%低く、細胞内の活性体(テノホビル二リン酸)曝露量は約4倍高くなることが認められました。
(テノホビル アラフェナミド(TAF)の特性(1)の項参照) -
ゲンボイヤ配合錠は、軽度から中等度の腎機能障害〔推算糸球体濾過量(eGFR)30mL/min以上70mL/min未満〕を有するHIV-1感染症患者を対象とした臨床試験において、1日1回1錠の服用による有効性及び安全性が審査され承認されました。
- 治療未経験者ならびに治療経験者を対象とした臨床試験で有効性が認められました。(海外データ)
- 副作用発現率は31.3%(1,825例中571例)でした。(承認時)
抗HIV薬による治療経験がないHIV-1感染症患者を対象とした本剤の海外臨床試験(投与後96週時)において、866例中367例(42.4%)に副作用が認められました。主な副作用は、悪心90例(10.4%)、下痢63例(7.3%)、頭痛53例(6.1%)等でした。また、抗HIV薬による治療経験があり、ウイルス学的に抑制されているHIV-1感染症患者を対象とした本剤の海外臨床試験(投与後48週時)において、959例中204例(21.3%)に副作用が認められました。主な副作用は、下痢24例(2.5%)、悪心22例(2.3%)等でした。(承認時)
| 重大な副作用 | 腎不全又は重度の腎機能障害
(1%未満):腎機能不全、腎不全、急性腎障害、近位腎尿細管機能障害、ファンコニー症候群、急性腎尿細管壊死、腎性尿崩症又は腎炎等の重度の腎機能障害 乳酸アシドーシス(頻度不明)※ |
|---|
- エムトリシタビン又はテノホビル ジソプロキシルフマル酸塩を含有する製剤の臨床試験、製造販売後調査及び自発報告等で報告された副作用を示しました。
テノホビル アラフェナミド(TAF)の特性(1)
TAFの代謝メカニズム(1)-(3)
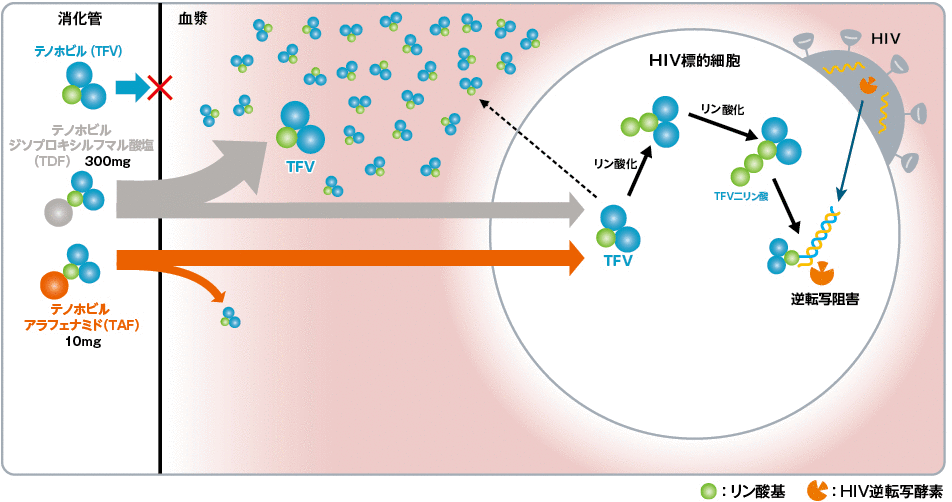
TAFは、テノホビル(TFV)の新規プロドラッグです。 TAFは、経口吸収後、効率的にHIV標的細胞(CD4リンパ球など)内に移行します。細胞内では主にカテプシンAにより加水分解を受け、中間代謝産物であるTFV-アラニンを経た後、TFVに代謝されます。その後、細胞内酵素によりリン酸化を受け、抗HIV活性のあるTFV二リン酸に変換されます。 TAFは血漿中で安定であり、既存のTFVのプロドラッグであるTDFと比較して、1/10程度の投与量で同様の抗ウイルス活性を示し、TFVの血漿中濃度も低く抑えることが可能となりました(2),(3)。
血漿中TFV濃度及び細胞内のTFVニリン酸曝露量(外国人データ)(1)
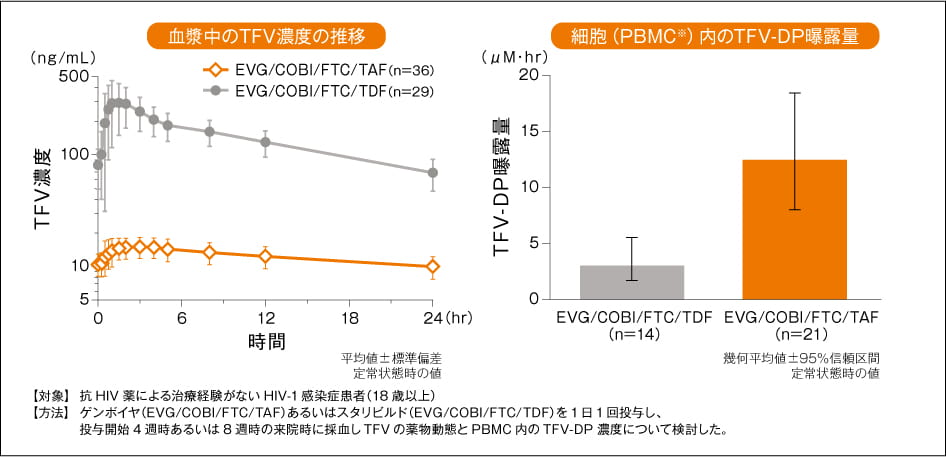
TAF投与時の血漿中TFV曝露量(AUC)は、TDF投与時と比べ約90%低く、細胞(PBMC※)内のTFV二リン酸(TFVーDP)曝露量はTDF投与時と比べて約4倍高くなります。 このことから、TAFはTDFの1/10程度の投与量でTDFと同程度の抗ウイルス活性と、TDFで懸念される腎臓や骨に対する影響の低減が考えられます。
- PBMC:peripheral blood mononuclear cells(末梢血単核細胞)
- Sax P.E. et al. : Lancet 385(9987):2606-2615, 2015.
- Ruane P.J. et al. : J Acquir Immune Defic Syndr. 63(4):449-455, 2013.
- Gilead社:社内資料 292-0101試験
テノホビル アラフェナミド(TAF)の特性(2)
ゲンボイヤ配合錠におけるTAFの用量について<
TAF単剤の抗ウイルス効果を検討した第Ⅰ相臨床試験(120-0104試験)において、TAFの至適用量は25mgと設定されました。 また、TAF 25mgをエルビテグラビル(EVG;E)150mg、コビシスタット(COBI;C)150mg及びエムトリシタビン(FTC;F)200mgと配合した製剤(E/C/F/TAF 150/150/200/25mg)を用いた第Ⅰ相臨床試験(292-0101試験)(3)を実施したところ、TAFの曝露量は、TAF 25mg単剤投与時と比較して約2.5倍高いことが示されました。 TAFは腸管等に発現している薬剤排出トランスポーターのP糖蛋白質(P-glycoprotein;P-gp)の基質であることから、P-gp阻害作用を有するCOBIとの併用投与によりTAFの曝露量が上昇したと考えられました。
この結果を受けて、TAFの含有量を10mgに変更した製剤(E/C/F/TAF 150/150/200/10mg:ゲンボイヤ配合錠)を用いた第Ⅰ相臨床試験(292-0103試験)を実施したところ、TAFのAUClast及びCmaxはFTC 200mgとTAF 25mgを併用した時と同程度でした。
剤型の違いによるTAFの薬物動態の変化(292-0103試験)(外国人データ)
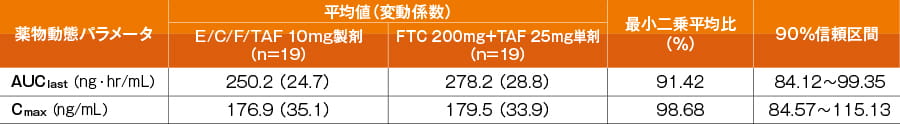
これらの試験結果から、以降の臨床試験で用いるE/C/F/TAFに含有するTAFの至適用量は10mg(TAFフマル酸塩として11.2mg)と設定されました。
TAF投与時の腎尿細管細胞への影響(1)-(3)
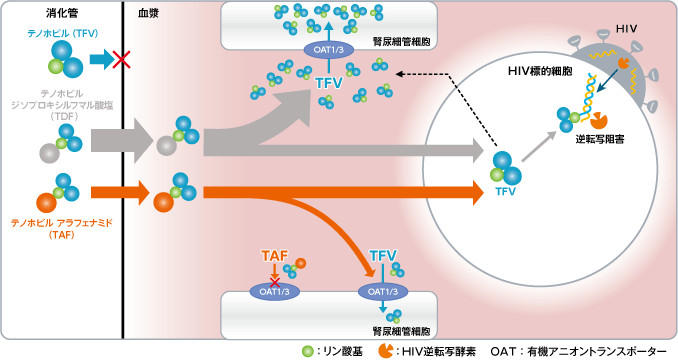
TDFの大部分が血漿中でTFVに代謝されるのに対し、TAFはその大部分がHIV標的細胞内でTFVに代謝されるため、より効率的にウイルス標的細胞内にTFVを送達させることができます。そのためTDF投与後と比較して、TAF投与後の血漿中TFV濃度は低く、OAT1/3を介した腎尿細管細胞へのTFVの取り込み量が低下します(2),(4)-(7)。 また、TAF自体はOAT1/3の基質ではないため、OAT1/3を介した腎尿細管細胞内への取り込みは起こりません(8)。
- Sax P.E. et al. : Lancet 385(9987):2606-2615, 2015.
ギリアド・サイエンシズ株式会社より資金提供 - Ruane P.J. et al. : J Acquir Immune Defic Syndr. 63(4):449-455, 2013.
ギリアド・サイエンシズ株式会社より資金提供 - Gilead社:社内資料 292-0101試験
- Birkus G. et al. : Mol Pharmacol. 74(1):92-100, 2008.
著者にギリアド・サイエンシズ株式会社の従業員を含む - Lee W.A. et al. : Antimicrob Agents Chemother. 49 : 1898-1906, 2005.
著者にギリアド・サイエンシズ株式会社の従業員を含む - Ray A.S. et al. : Antimicrob Agents Chemother. 50 : 3297-3304, 2006.
著者にギリアド・サイエンシズ株式会社の従業員を含む - Ruane P.J. et al. : J Acquir Immune Defic Syndr. 63(4):449-455, 2013.
ギリアド・サイエンシズ株式会社より資金提供 - Bam R.A. et al. : Antivir Ther. 19 : 687-692, 2014.
著者全員がギリアド・サイエンシズ株式会社の従業員







