1489/1490試験 安全性
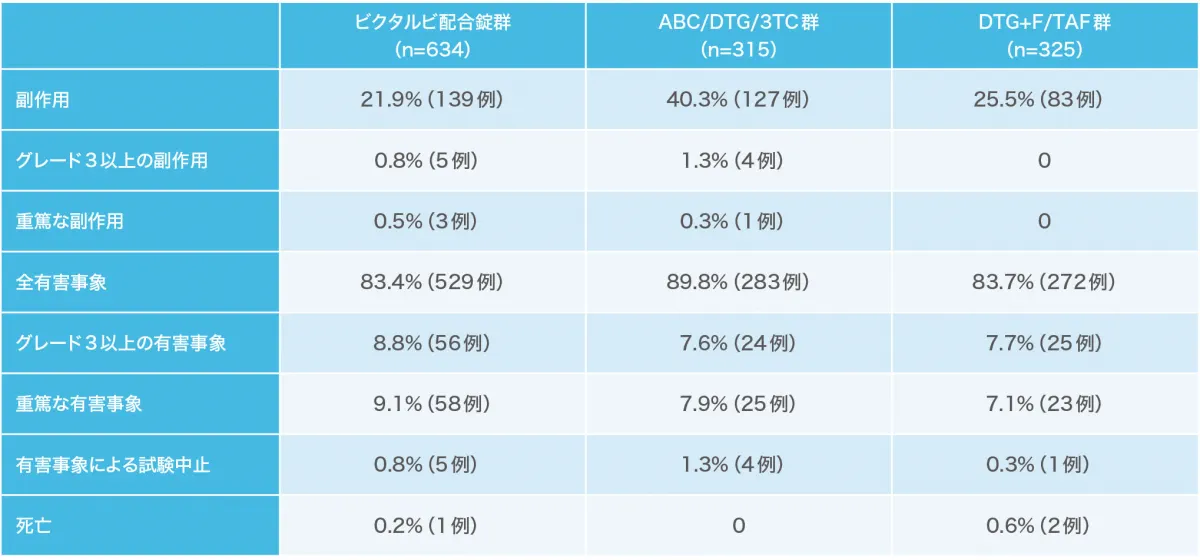
投与48週時点の有害事象および副作用の発現状況[1489試験および1490試験(安全性解析対象集団)](副次評価項目)(海外データ)
投与48週時点で、ビクタルビ配合錠群で634例中139例(21.9%)、ABC/DTG/3TC群で315例中127例(40.3%)、DTG+F/TAF群で325例中83例(25.5%)に臨床検査値異常を含む副作用が認められました。主な副作用は、ビクタルビ配合錠群で頭痛29例(4.6%)、下痢29例(4.6%)、悪心26例(4.1%)等、ABC/DTG/3TC群で悪心55例(17.5%)、頭痛15例(4.8%)、下痢13例(4.1%)、DTG+F/TAF群で悪心17例(5.2%)、下痢11例(3.4%)、頭痛10例(3.1%)等でした。
重篤な副作用として、ビクタルビ配合錠群で胸痛、自殺企図、全身性強直性間代性発作各1例が認められました。
ABC/DTG/3TC群で1例に胃腸炎、脂肪便および慢性膵炎が認められました。投与中止に至った副作用として、ビクタルビ配合錠群で胸痛1例、腹部膨満1例、睡眠障害、消化不良、緊張性頭痛、抑うつ気分および不眠症1例、ABC/DTG/3TC群で、悪心と全身性皮疹1例、血小板減少症1例、慢性膵炎と脂肪便1例、うつ病1例が認められました。死亡はビクタルビ配合錠群で1例、DTG+F/TAF群で2例認められましたが、治験薬との関連は否定されました。
有害事象および副作用の発現割合(例数)は下表の通りです。
投与48週時点の有害事象および副作用の発現状況[1489試験(安全性解析対象集団)](副次評価項目)(海外データ)
投与開始48週のビクタルビ配合錠群の副作用発現割合は26%でした。有害事象の中で、悪心はビクタルビ配合錠群では対照群より有意に少ない発現割合でした。
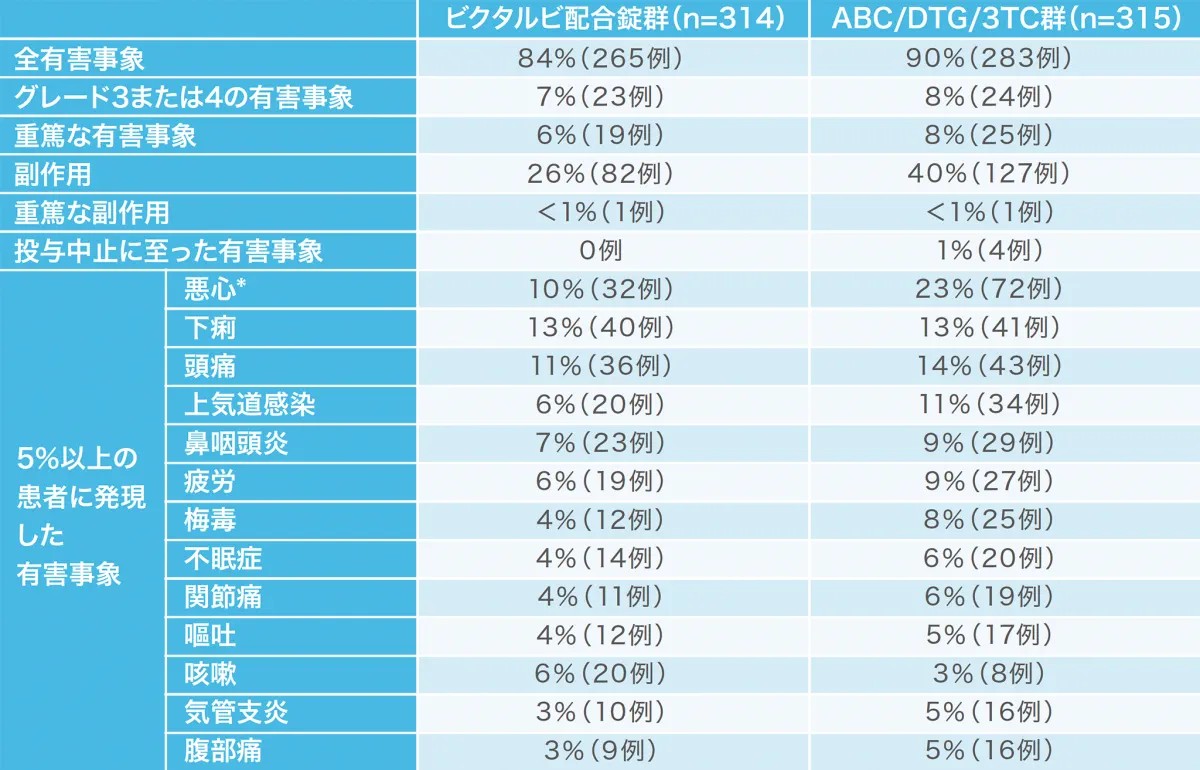
*:p<0.0001(ビクタルビ配合錠群 vs ABC/DTG/3TC群、Fisherの正確確率検定)
重篤な副作用として、ビクタルビ配合錠群で1例に全身性強直性間代性発作、ABC/DTG/3TC群で1例に胃腸炎、脂肪便および慢性膵炎が認められた。投与中止に至った副作用として、ABC/DTG/3TC群で、悪心と全身性皮疹1例、血小板減少症1例、慢性膵炎と脂肪便1例、うつ病1例が認められた。
ABC:アバカビル、DTG:ドルテグラビル、 3TC:ラミブジン
Gallant J, et al.: Lancet 2017; 390: 2063.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与48週時点の脊椎および寛骨(大腿骨近位部)の骨密度のベースラインからの変化率[1489試験(安全性解析対象集団)](副次評価項目)(海外データ)
DXA法を用いて、ベースラインから投与48週までの脊椎および寛骨(大腿骨近位部)の骨密度の変化率を比較したところ、各投与群で同様の結果でした。投与48週時点におけるベースラインからの変化率の平均値(標準偏差)は、脊椎では、ビクタルビ配合錠群が−0.83%(3.19%)、ABC/DTG/3TC群が−0.60%(3.10%)であり、2群の最小二乗平均値の差(95%信頼区間)は−0.24%(−0.77〜0.30%)でした。また、寛骨(大腿骨近位部)では、ビクタルビ配合錠群が−0.78%(2.22%)、ABC/DTG/3TC群が−1.02%(2.31%)であり、2群の最小二乗平均値の差(95%信頼区間)は0.24%(−0.15〜0.63%)でした。
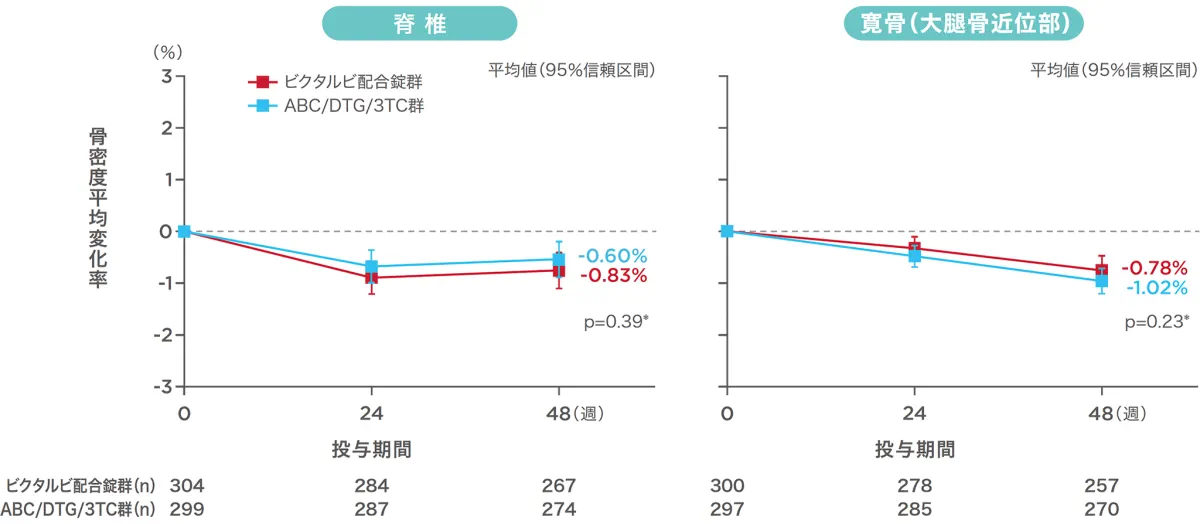
ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
*: ANOVA(ビクタルビ配合錠群 vs ABC/DTG/3TC群)
Gallant J, et al.: Lancet 2017; 390: 2063.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与48週時点の腎バイオマーカーのベースラインからの変化[1489試験(安全性解析対象集団)](副次評価項目)(海外データ)
1489試験において、UACR*、尿中RBP†/クレアチニン比および尿中β2マイクログロブリン/クレアチニン比のベースラインからの変化率の中央値は投与群間で同様でした。
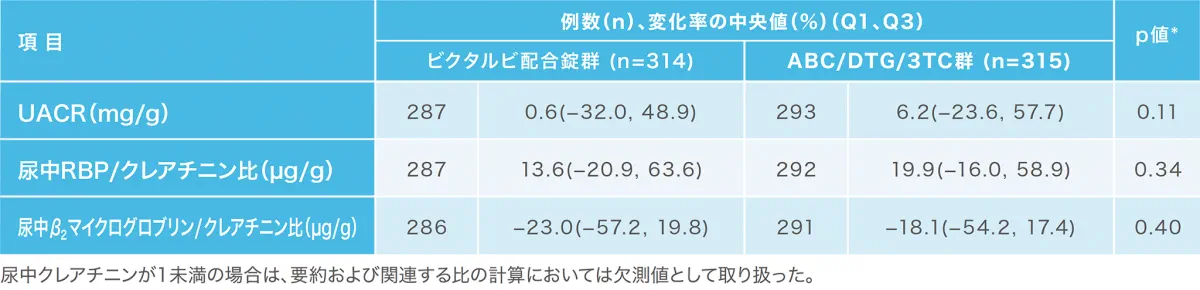
UACR:尿中アルブミン/クレアチニン比、RBP:レチノール結合蛋白、ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
*:両側ウィルコクソンの順位和検定(ビクタルビ配合錠群 vs ABC/DTG/3TC群)
社内資料(Phase 3 study : GS-US-380-1489)(承認時評価資料)
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与48週時点の有害事象および副作用の発現状況[1490試験(安全性解析対象集団)](副次評価項目)(海外データ)
投与開始48週のビクタルビ配合錠群の副作用発現割合は18%であり、対照群より有意に少ない割合でした。
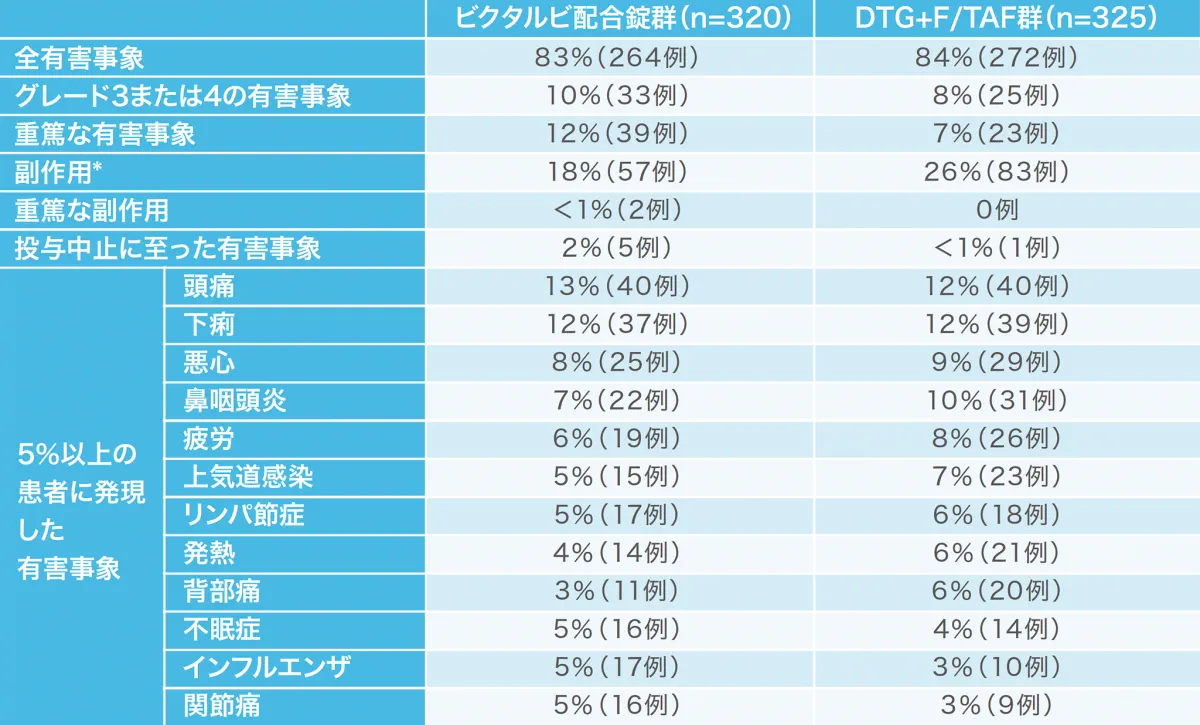
*:p=0.022(ビクタルビ配合錠群 vs DTG+F/TAF群、Fisherの正確確率検定)
重篤な副作用として、ビクタルビ配合錠群で胸痛、自殺企図各1例が認められた。投与中止に至った副作用として、ビクタルビ配合錠群で胸痛1例、腹部膨満1例、睡眠障害、消化不良、緊張性頭痛、抑うつ気分および不眠症1例が認められた。死亡はビクタルビ配合錠群で1例、DTG+F/TAF群で2例認められたが、治験薬との関連は否定された。
DTG:ドルテグラビル、F:エムトリシタビン、TAF:テノホビル アラフェナミド
Sax PE, et al.: Lancet 2017; 390: 2073.
上記試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与48週時点の空腹時脂質パラメータのベースラインからの変化量[1489試験および1490試験(安全性解析対象集団)](副次評価項目)(海外データ)
投与96週時点の有害事象および副作用の発現状況[1489試験(安全性解析対象集団)](副次評価項目)(海外データ)
抗HIV薬による治療経験がないHIV-1感染症患者を対象にした1489試験において、投与開始96週のビクタルビ配合錠群の副作用発現割合は28%であり、対照群より有意に少ない割合でした。
*:このうちの1例は当初の解析時には副作用と報告されたが、その後情報が追加され、治験薬と関連がないとされた。
†:p=0.002(ビクタルビ配合錠群 vs ABC/DTG/3TC群、Fisherの正確確率検定)
‡:p=0.0001(ビクタルビ配合錠群 vs ABC/DTG/3TC群、Fisherの正確確率検定)
重篤な副作用として、ビクタルビ配合錠群で全身性強直間代性発作、自然流産各1例、ABC/DTG/3TC群で胃腸炎、脂肪便、慢性膵炎1例が認められた。投与中止に至った副作用は、ビクタルビ配合錠群では認められなかった。ABC/DTG/3TC群では、悪心と全身性皮疹1例、血小板減少症1例、慢性膵炎と脂肪便1例、うつ病1例が認められた。死亡はビクタルビ配合錠群で2例(ドラッグの過剰摂取、自殺各1例)認められたが、治験薬との関連は否定された。
ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
Wohl DA, et al.: Lancet HIV 2019; 6(6):e355.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与96週時点の脊椎および寛骨(大腿骨近位部)の骨密度のベースラインからの変化率[1489試験(安全性解析対象集団)](副次評価項目)(海外データ)
抗HIV薬による治療経験がないHIV-1感染症患者を対象とした1489試験において、ビクタルビ配合錠群の脊椎と寛骨(大腿骨近位部)の骨密度の変化率は投与開始後96週でそれぞれ、ー0.71%、ー1.13%でした。
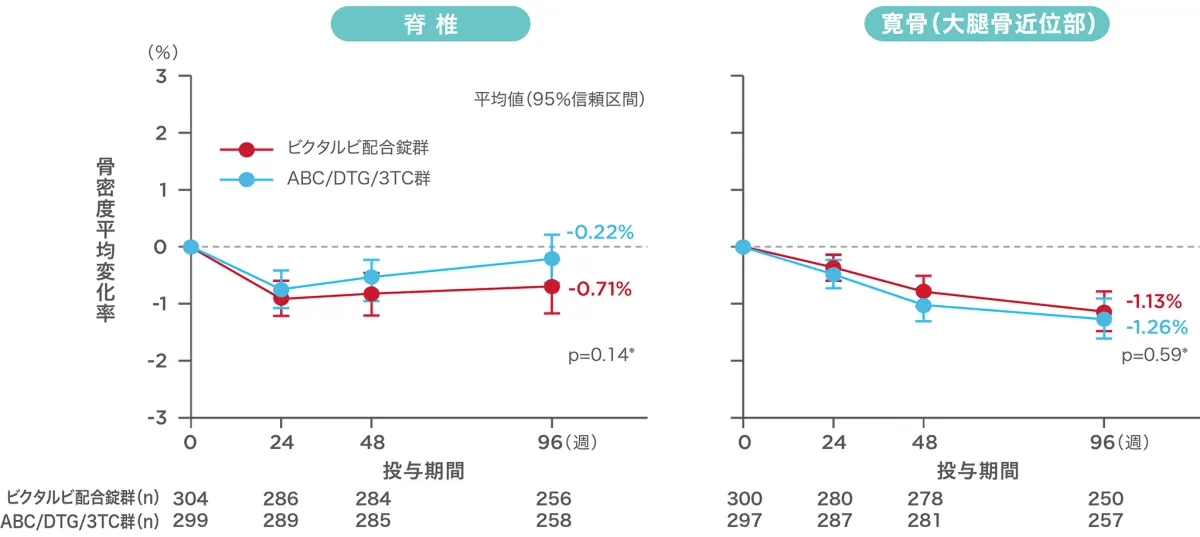
ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン、*: ANOVA(ビクタルビ配合錠群 vs ABC/DTG/3TC群)
Wohl DA, et al.: Lancet HIV 2019; 6(6):e355.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与96週時点の腎バイオマーカーのベースラインからの変化[1489試験(安全性解析対象集団)](副次評価項目)(海外データ)
抗HIV薬による治療経験がないHIV-1感染症患者を対象とした1489試験において、ビクタルビ配合錠群のUACR、尿中β2マイクログロブリン/クレアチニン比、尿中RBP/クレアチニン比の変化率は投与開始後96週でそれぞれ、ー0.3%、ー30.8%、21.2%でした。
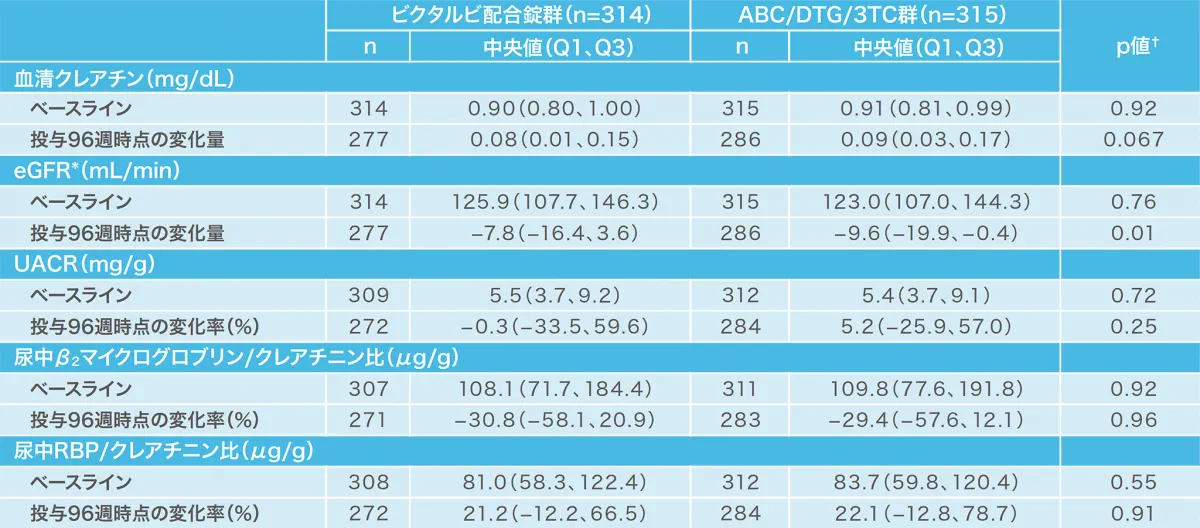
*:Cockcroft-Gault式による推算糸球体ろ過量
†:両側ウィルコクソンの順位和検定(ビクタルビ配合錠群 vs ABC/DTG/3TC群)
UACR:尿中アルブミン/クレアチニン比、RBP:レチノール結合蛋白、ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
Wohl DA, et al.: Lancet HIV 2019; 6(6):e355.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与96週時点の有害事象および副作用の発現状況[1490試験(安全性解析対象集団)] (副次評価項目)(海外データ)
抗HIV薬による治療経験がないHIV-1感染症患者を対象にした1490試験において、投与開始96週のビクタルビ配合錠群の副作用発現割合は20%であり、対照群より有意に少ない割合でした。
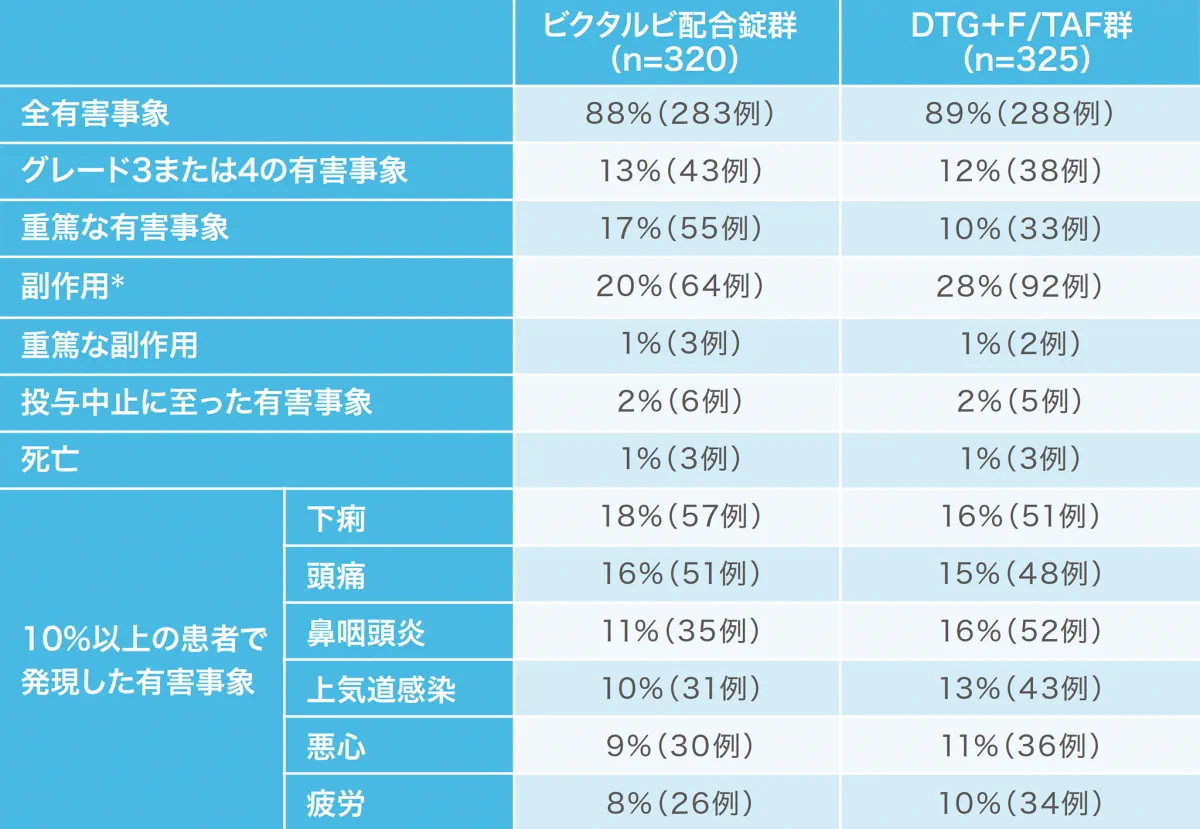
*:p=0.02(ビクタルビ配合錠群 vs DTG+F/TAF群、 Fisherの正確確率検定)
重篤な副作用はビクタルビ配合錠群で3例(胸痛等)に認められた。投与中止に至った副作用として、ビクタルビ配合錠群で胸痛1例、腹部膨満1例、睡眠障害、消化不良、緊張性頭痛、抑うつ気分および不眠症1例、DTG+F/TAF群でうつ病1例、脂肪萎縮症1例が認められた。死亡はビクタルビ配合錠群で3例(虫垂炎と敗血症性ショック後の心停止、胃腺癌、高血圧性心疾患とうっ血性心不全各1例)、
DTG+F/TAF群で3例(死因不明、慢性閉塞性肺疾患に伴う肺塞栓症、リンパ腫各1例)認められたが、治験薬との関連は否定された。
DTG:ドルテグラビル、F:エムトリシタビン、TAF:テノホビル アラフェナミド
Stellbrink HJ, et al.: Lancet HIV 2019; 6(6): e364.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
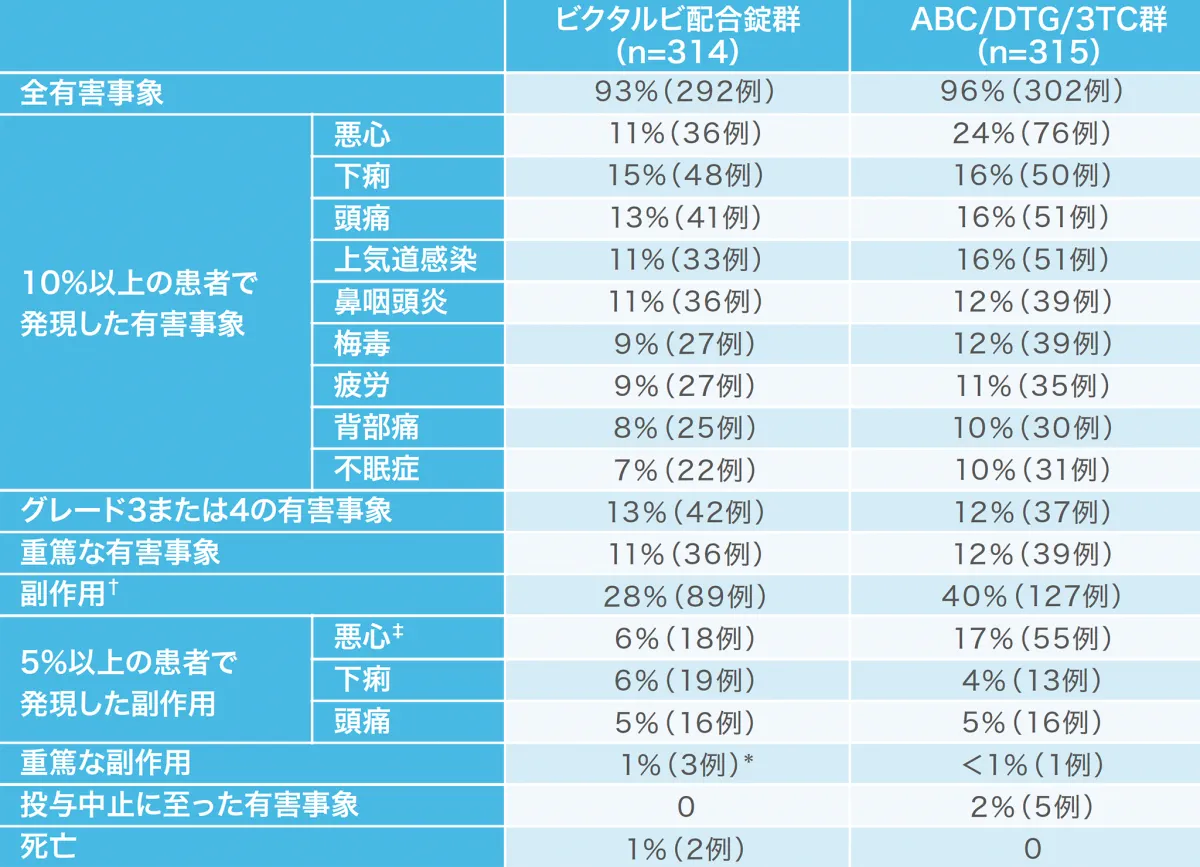
投与144週時点の有害事象および副作用の発現状況[1489試験および1490試験(安全性解析対象集団)](副次評価項目)
1489試験において、投与開始144週時点で、ビクタルビ配合錠群で314例中94例(30%)、ABC/DTG/3TC群で315例中132例(42%)に臨床検査値異常を含む副作用が認められました。ビクタルビ配合錠群では対照群より有意に少ない割合でした。
1490試験において、投与開始144週時点で、ビクタルビ配合錠群で320例中71例(22%)、DTG+F/TAF群で325例中95例(29%)に臨床検査値異常を含む副作用が認められました。
主な有害事象、副作用は下表の通りでした。
1489試験では、重篤な副作用として、ビクタルビ配合錠群で全身性強直間代性発作、自然流産各1例、ABC/DTG/3TC群で胃腸炎、脂肪便、慢性膵炎1例が認められました。投与中止に至った副作用は、ビクタルビ配合錠群では認められませんでした。ABC/DTG/3TC群では、悪心と全身性皮疹1例、血小板減少症1例、慢性膵炎と脂肪便1例、うつ病1例が認められました。死亡はビクタルビ配合錠群で2例(ドラッグの過剰摂取、自殺各1例)、ABC/DTG/3TC群で1例(ドラッグの過剰摂取)認められましたが、治験薬との関連は否定されました。
1490試験では、重篤な副作用はビクタルビ配合錠群で3例(胸痛等)、DTG+F/TAF群で3例に認められました。投与中止に至った副作用として、ビクタルビ配合錠群で胸痛1例、腹部膨満1例、睡眠障害、消化不良、緊張性頭痛、抑うつ気分および不眠症1例、うつ病1例、DTG+F/TAF群でうつ病1例、脂肪萎縮症1例が認められました。死亡はビクタルビ配合錠群で4例(虫垂炎と敗血症性ショック後の心停止、胃腺癌、高血圧性心疾患とうっ血性心不全、心臓突然死各1例)、DTG+F/TAF群で4例(死因不明2例、肺塞栓症、リンパ腫各1例)認められました。治験薬と関連がある可能性があるとされたDTG+F/TAF群の死因不明の1例を除いて治験薬との関連は否定されました。

ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン、 F:エムトリシタビン、TAF:テノホビル アラフェナミド
*:群間差が5%超の場合に有意差について統計学的検定を行った(Fisherの正確確率検定)。
Orkin C, et al.: Lancet HIV 2020; 7: e389.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与144週時点の脊椎および寛骨(大腿骨近位部)の骨密度のベースラインからの変化率[1489試験(安全性解析対象集団)](副次評価項目)
DXA法を用いて、ベースラインから投与144週までの脊椎および寛骨(大腿骨近位部)の骨密度の変化率を比較したところ、各投与群で同様の結果でした。投与144週時点におけるベースラインからの変化率の平均値は、脊椎では、ビクタルビ配合錠群が−0.37%、ABC/DTG/3TC群が+0.04%でした。また、寛骨(大腿骨近位部)では、ビクタルビ配合錠群が−1.02%、ABC/DTG/3TC群が−1.29%でした。

ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
*:ANOVA(ビクタルビ配合錠群 vs ABC/DTG/3TC群)
Orkin C, et al.: Lancet HIV 2020; 7: e389.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
投与144週時点の腎バイオマーカーのベースラインからの変化[1489試験および1490試験(安全性解析対象集団)](副次評価項目)
UACR*、尿中RBP†/クレアチニン比および尿中β2マイクログロブリン/クレアチニン比のベースラインからの変化率の中央値は投与群間で同様でした。

*:尿中アルブミン/クレアチニン比、†:レチノール結合蛋白、‡:Cockcroft-Gault 式による推算糸球体ろ過量
ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
p値は両側ウィルコクソンの順位和検定による(ビクタルビ配合錠群 vs 対照群)。
Orkin C, et al.: Lancet HIV 2020; 7: e389.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
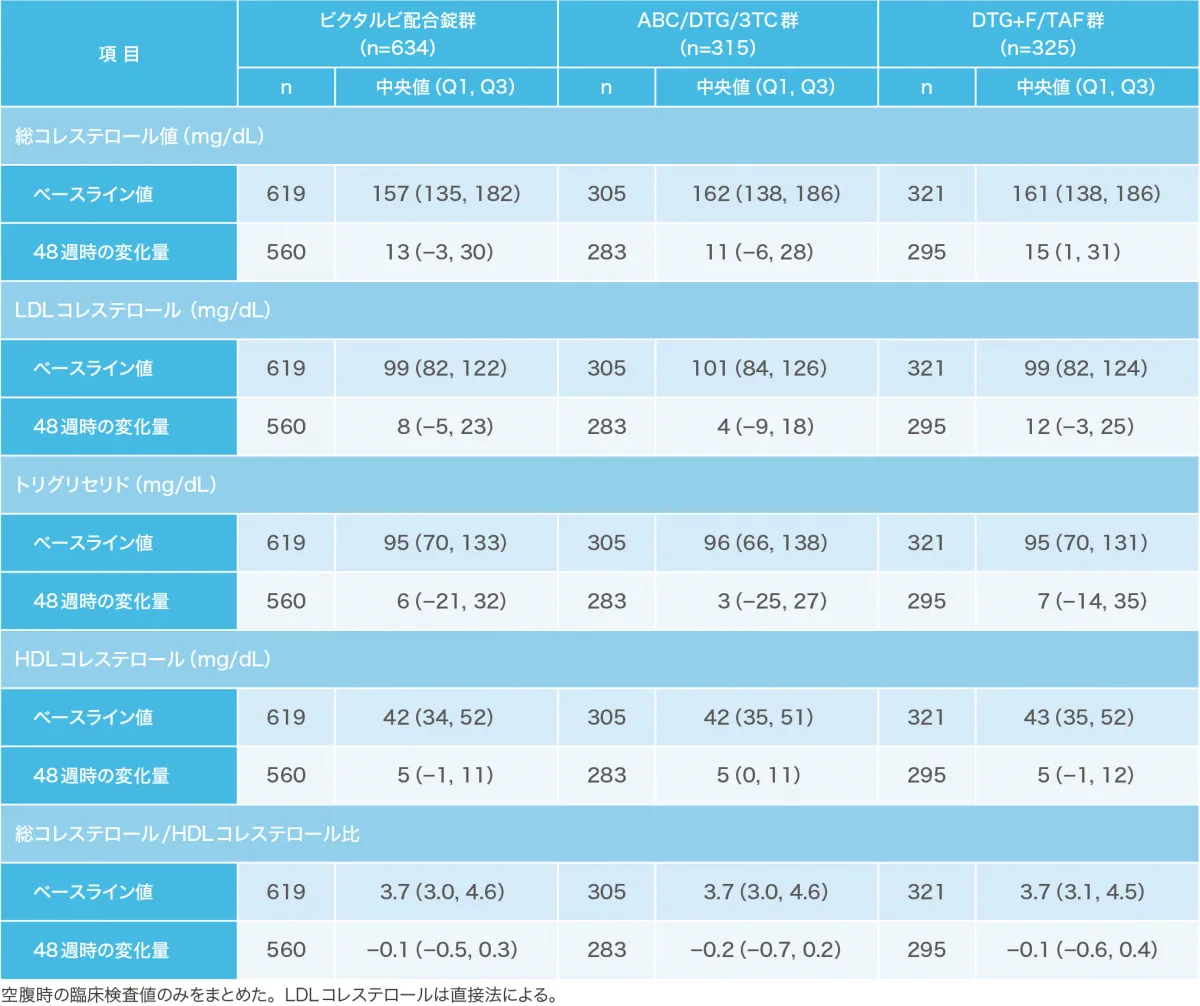
投与144週時点の空腹時脂質パラメータおよび体重のベースラインからの変化量[1489試験および1490試験(安全性解析対象集団)](副次評価項目)

空腹時の臨床検査値のみをまとめた。LDLコレステロールは直接法による。
ABC:アバカビル、DTG:ドルテグラビル、3TC:ラミブジン
p値は両側ウィルコクソンの順位和検定による(ビクタルビ配合錠群 vs 対照群)。
Orkin C, et al.: Lancet HIV 2020; 7: e389.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。







