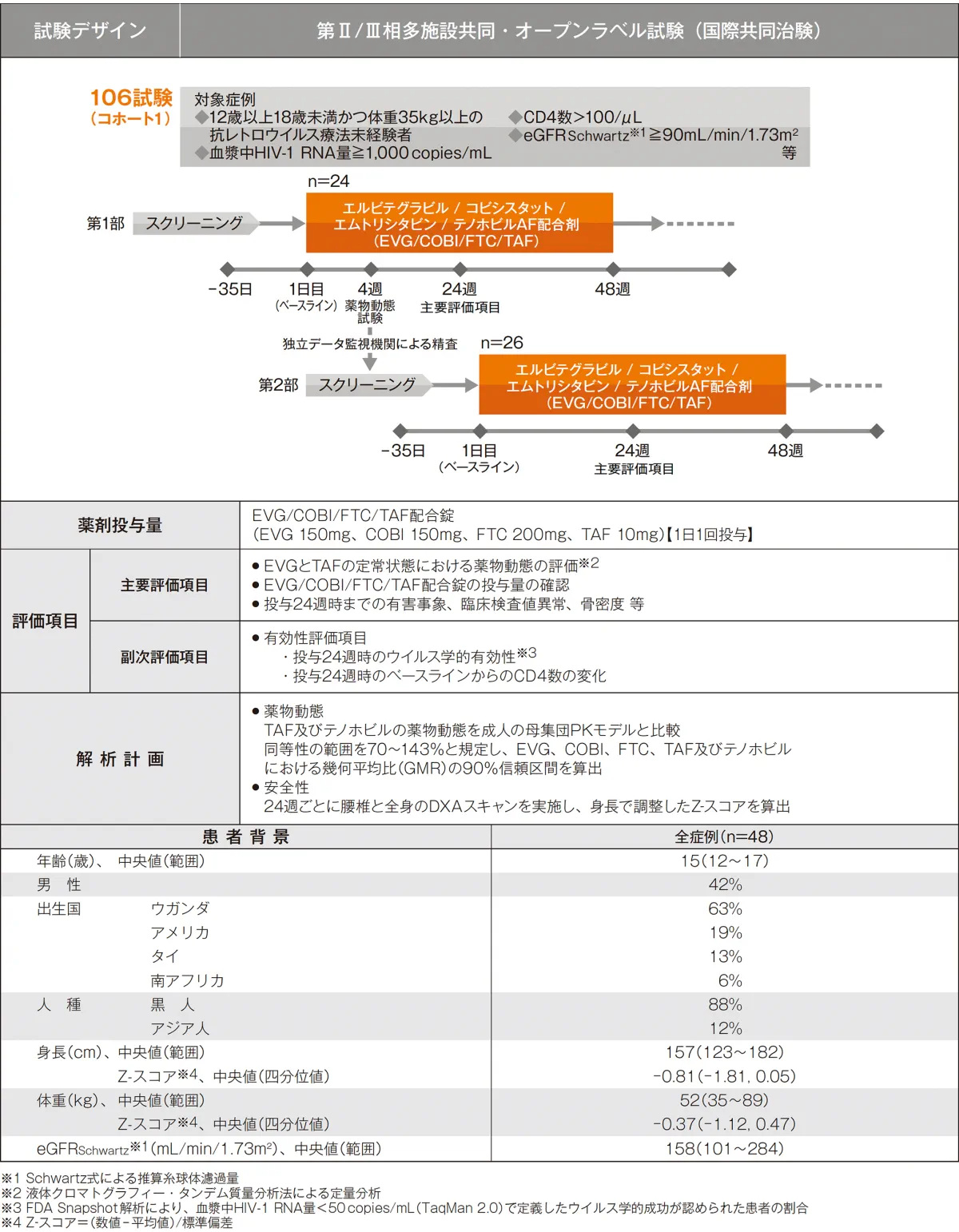
試験概要
試験の概要は以下のとおりです。
ウイルス学的効果:FDA Snapshot解析(24週【副次評価項目】)
投与24週の血漿中HIV-1 RNA量が50 copies/mL未満でウイルス学的有効性が認められた患者の比率は、91%でした。

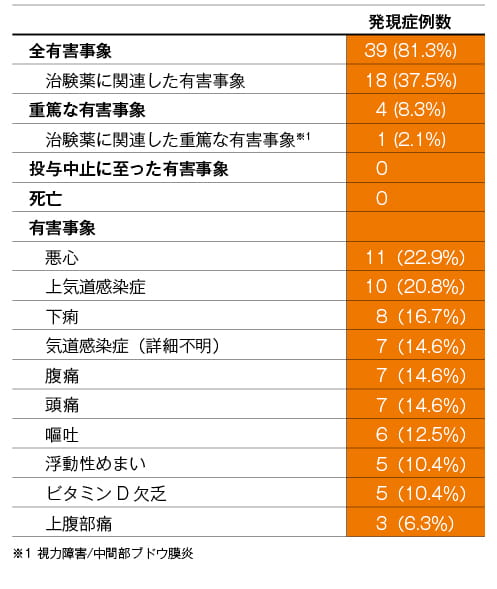
有害事象
投与24週までの試験期間中に認められた主な有害事象を以下に示します。
主な有害事象(n=48)(24週【主要評価項目】)
【用法・用量】
通常、成人及び体重25kg以上の小児には、1回1錠(エルビテグラビルとして150mg、コビシスタットとして150mg、エムトリシタビンとして200mg及びテノホビル
アラフェナミドとして10mgを含有)を1日1回食後に経口投与する。
【使用上の注意】(抜粋)
7.小児等への投与
低出生体重児、新生児、乳児、幼児又は体重25kg未満の小児に対する安全性は確立していない。







