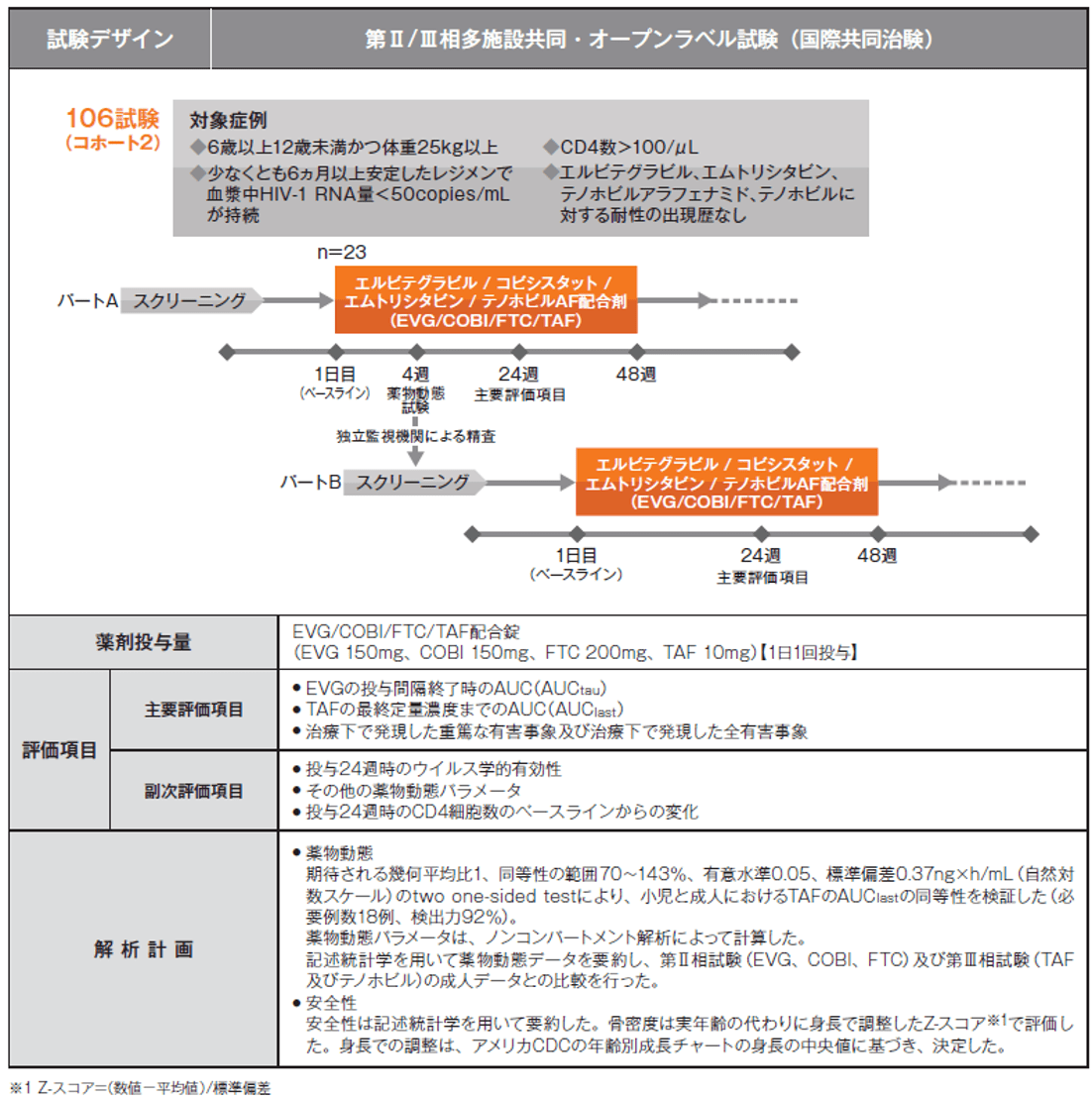
292-0106試験(106試験 コホート2)(海外データ、国際共同治験)
安定したレジメン下で6ヵ月以上ウイルス学的に抑制されている外国人小児HIV-1感染症患者(6歳以上 12歳未満かつ体重25kg以上)を対象とした、ゲンボイヤ配合錠の安全性・有効性・薬物動態試験
ゲンボイヤ配合錠とスタリビルド配合錠(EVG/COBI/FTC/TDF)との非劣性試験
Natukunda E. et al. : Lancet Child Adolesc Health 1(1): 27-34, 2017.
〔利益相反〕 本研究はGilead Sciences社の資金により実施された。
試験概要
試験の概要は以下のとおりです。
ウイルス学的効果:FDA Snapshot解析(24週【副次評価項目】)
すべての患者(23/23例)において投与24週の血漿中HIV-1 RNA量が50 copies/mL未満となりウイルス学的有効性が認められました。
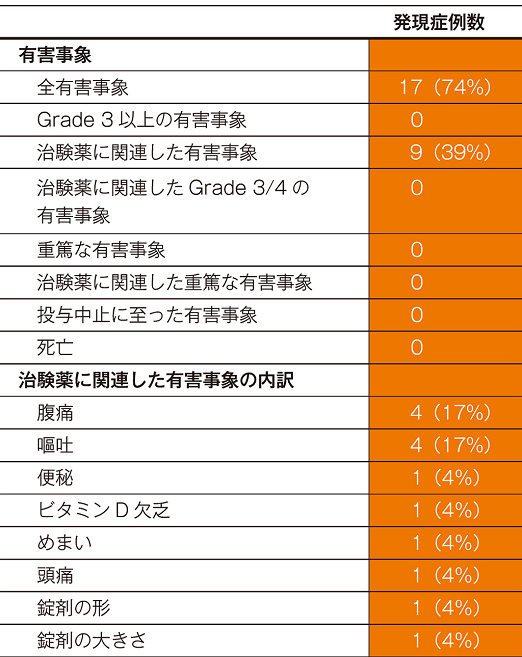
有害事象
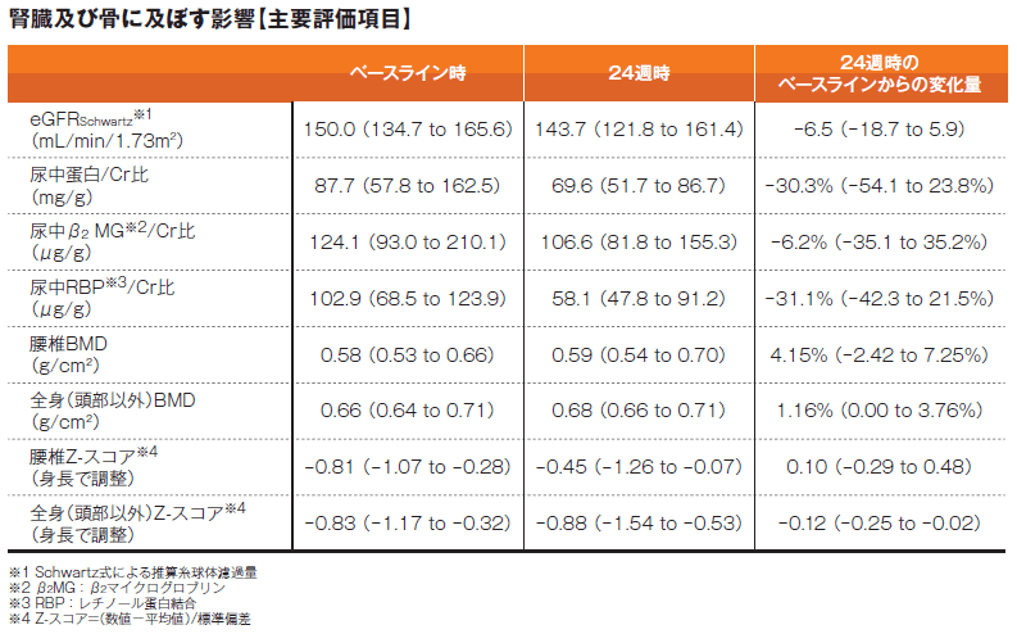
投与24週までの試験期間中に認められた主な有害事象及び骨密度の変化を以下に示します。
主な有害事象(n=23)(24週【主要評価項目】)
【用法・用量】
通常、成人及び体重25kg以上の小児には、 1回1錠(エルビテグラビルとして150mg、コビシスタットとして150mg、エムトリシタビンとして200mg及びテノホビル
アラフェナミドとして10mg を含有)を1日1回食後に経口投与する。
【使用上の注意】(抜粋)
7.小児等への投与
低出生体重児、新生児、乳児、幼児又は体重25kg未満の小児に対する安全性は確立していない。







