「禁忌を含む注意事項等情報」等はDIをご参照ください。
NIAID ACTT-1試験(国際共同第Ⅲ相試験)
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
試験概要
| 目的 | SARS-CoV-2による感染症患者を対象に、ベクルリー10日間投与の有効性と安全性を検討する。 |
| 試験デザイン | 多施設共同、無作為化、二重盲検、プラセボ対照、並行群間試験 |
| 対象 | 18歳以上のSARS-CoV-2による感染症患者1,062例(うち日本人15例) |
| 主な選択基準 |
|
| 主な除外基準 |
|
| 試験方法 | 患者を、ベクルリーを初日に200mg、2日目以降は100mgを1日1回、10日目まで静脈内投与する群とプラセボを1日1回、10日目まで静脈内投与する群に1:1の割合で無作為に割り付けた。なお、すべての患者は治験薬投与に加えて各国のSARS-CoV-2による感染症治療に関するガイドライン等に従った標準療法の実施が可能とされた。 |
| 主要評価項目 (検証的な解析項目) |
無作為化後28日目までにおける回復(8点順序尺度のスコア1~3に該当)までの時間 |
| 副次評価項目 | 無作為化後2、4、7、10、14、21、28日目における臨床状態、8点順序尺度スコアにおける1段階又は2段階の改善までの時間、無作為化後0日目から2、4、7、10、14、21、28日目までの臨床状態の変化、退院又はNational Early Warning Scoreにおける2点以下のいずれかを達成するまでの時間、酸素吸入、非侵襲的換気又は高流量酸素、侵襲的人工呼吸器又はECMOによる管理を要する時間、新たに酸素吸入、非侵襲的換気又は高流量酸素、侵襲的人工呼吸器又はECMOによる管理を要するに至った患者割合とその場合の継続時間、無作為化後28日目までの入院日数、無作為化後14日、28日間の死亡率、有害事象の発現状況 など |
| 解析計画 | 回復は、患者が8点順序尺度[スコア1:退院かつ活動に制限なし、スコア2:退院かつ活動が制限及び/又は在宅酸素吸入が必要、スコア3:入院しており酸素吸入を要しない-治療の継続が不要、スコア4:入院、酸素吸入を要しない-治療の継続が必要(COVID-19関連又はそれ以外)、スコア5:入院かつ、酸素吸入を要する、スコア6:入院かつ非侵襲的人工呼吸器又は高流量酸素による管理、スコア7:入院かつECMO又は侵襲的人工呼吸器による管理、スコア8:死亡]の1、2、3のうちのいずれかを満たすことと定義した。 主要評価項目である回復までの時間はベースライン時の重症度で層別したlog-rank検定で評価し、回復率比を層別化Coxモデルで算出した。主要評価項目及び臨床状態についてベースライン時の属性(性別、年齢など)、重症度、症状の持続期間によるサブグループ解析を行った。 |
試験のサマリー
- ベクルリーは、COVID-19患者の回復までの時間を短縮し、臨床症状の改善や病態の進行抑制に効果があること、さらに一部の患者において死亡率を低下させることが示されました。
- 試験デザイン
・ACTT-1試験には1,000名を超えるCOVID-19中等症、重症患者が含まれており、その結果はNEJMに公表されています1。
- 回復までの時間(主要評価項目、検証的な解析結果)
・ベクルリーは、回復までの時間を5日間短縮しました〔10日:ベクルリー群 vs 15日:プラセボ群(回復率比1.29、95%CI1.12‐1.49、p<0.001、層別log-rank検定。
・重症/重篤患者では、回復までの時間はベクルリー群で11日、プラセボ群で18日でした。
・症状の発症から10日以内の患者では、ベクルリー群のプラセボ群に対する回復率比は1.37でした。
- 臨床症状の変化(副次評価項目)
・ベクルリーは、COVID-19患者の臨床症状を50%改善しました(OR:1.5、95%CI1.2‐1.9;p、p<0.001、名目上のp値、比例オッズモデル。
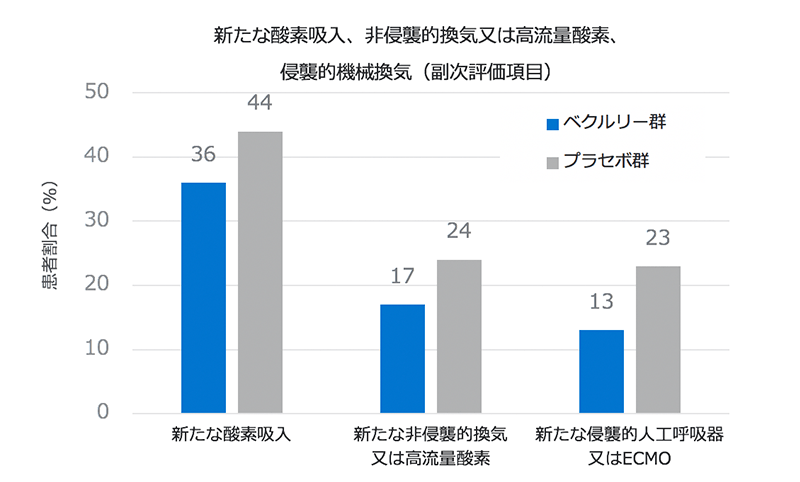
・侵襲的人工呼吸器又はECMOによるサポートが必要となる患者は、ベクルリー群ではプラセボ群と比較して43%少ない結果でした(13%:ベクルリー群 vs 23%:プラセボ群)。
- 死亡率(副次評価項目)
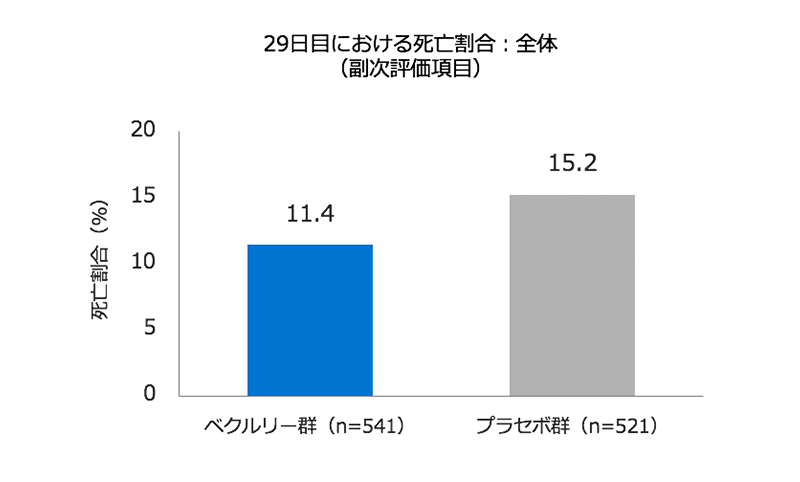
・試験期間を通じた死亡率はベクルリー群で11.4%、プラセボ群で15.2%でした。
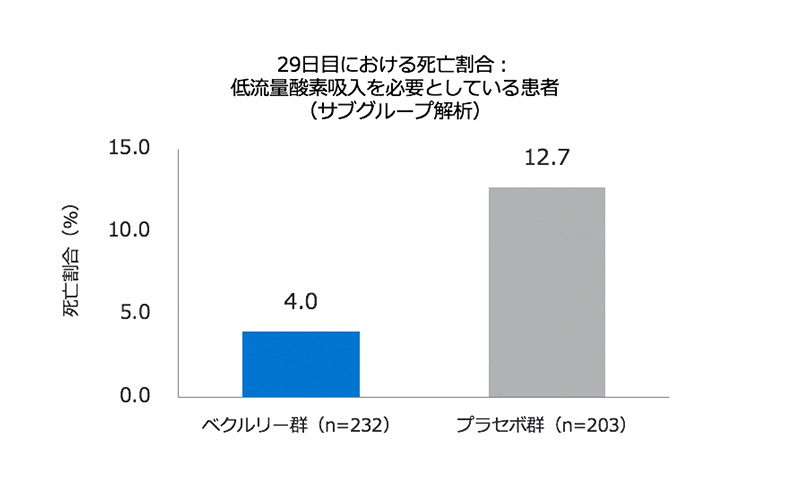
・低流量酸素吸入を必要としている患者群において、試験期間を通じた死亡率は、ベクルリー群で4.0%、プラセボ群で12.7%でした。
- 安全性(副次評価項目)
・重篤な有害事象はベクルリー群で131例、プラセボ群で163例に認められました。
・肝臓、腎臓に関連した有害事象を含む詳細については下記リンク先をご参照ください。
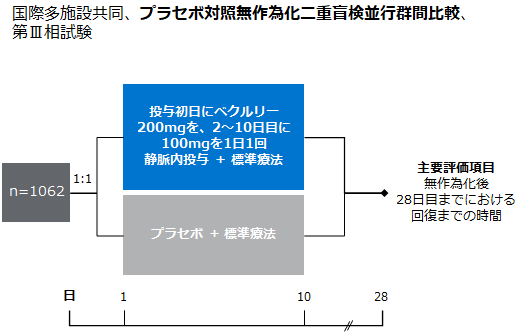
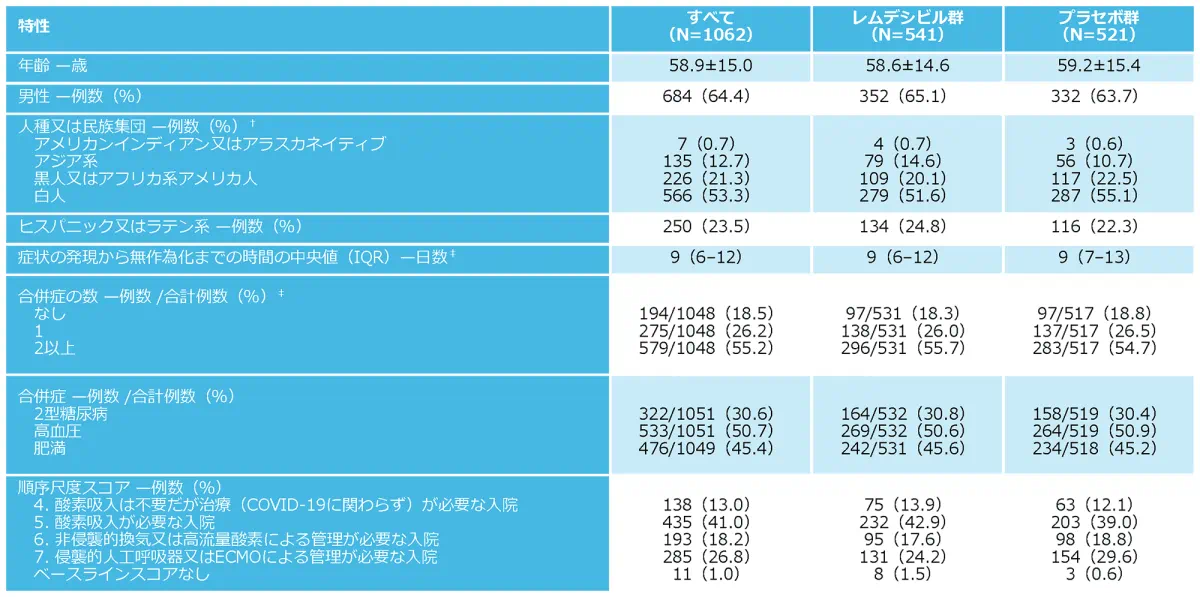
ACTT-1試験は18歳以上のSARS-CoV-2による感染症患者1,062例を対象とした国際多施設共同、プラセボ対照無作為化二重盲検並行群間比較、第Ⅲ相試験です。患者を無作為化し、ベクルリーを点滴静注で初日に200mg投与した後、10日目まで1日1回100mg投与する群とプラセボ群に1:1の比率で割り付けました。主要評価項目は無作為化後28日目までにおける回復(8点順序尺度のスコア1~3に該当)までの時間でした。ベースライン時の人口統計学的特性や臨床状態などの患者特性は両群間で同様でした。
回復までの時間(主要評価項目、検証的な解析結果)
- ベクルリーは、回復までの時間を5日間短縮しました〔10日:ベクルリー群 vs 15日:プラセボ群(回復率比1.29、95% CI 1.12-1.49、p<0.001)〕。
- 重症/重篤患者では、回復までの時間はベクルリー群で11日、プラセボ群で18日でした(回復率比1.31、95% CI 1.12-1.52)。
- 症状の発症から10日以内の患者では、ベクルリー群のプラセボ群に対する回復率比は1.37でした(95% CI 1.14-1.64)。

- †:
回復率比とハザード比は層別Coxモデル、p値は層別log-rank検定で算出した(実際の疾患重症度で層別化した全体モデル)。1を超える回復率比はレムデシビル群が優位であることを示す。
臨床症状の変化(副次評価項目)
- ベクルリー群はプラセボ群と比べて臨床状態の改善率が有意に高い値でした(OR:1.5、95% CI 1.2-1.9;p<0.001、名目上のp値、比例オッズモデル)。
- 侵襲的人工呼吸器又は体外式膜型人工肺(ECMO)によるサポートが必要となる患者は、ベクルリー群ではプラセボ群と比較して43%少ない結果でした(13%:ベクルリー群 vs 23%:プラセボ群)。
死亡率(副次評価項目)
- 試験期間を通じた死亡率はベクルリー群で11.4%、プラセボ群で15.2%でした(左図)(ハザード比0.73、95% CI 0.52–1.03)。
- 低流量酸素吸入を必要としている患者群において、試験期間を通じた死亡率は、ベクルリー群で4.0%、プラセボ群で12.7%でした(右図)(ハザード比0.30、95% CI 0.14–0.64)。
安全性(副次評価項目)
- 有害事象は、ベクルリー群で57%(305/532例)、プラセボ群で63%(323/516例)に認められました。重篤でない有害事象は、ベクルリー群では51.9%(276/532例)、プラセボ群では57.2%(295/516例)に認められました。主な重篤でない有害事象は、ベクルリー群で糸球体濾過率減少10.3%(55/532例)、ヘモグロビン減少9.0%(48/532例)、貧血7.9%(42/532例)、プラセボ群で糸球体濾過率減少14.3%(74/516例)、ヘモグロビン減少12.0%(62/516例)、リンパ球減少10.5%(54/516例)でした。
- 重篤な有害事象はベクルリー群で131例、プラセボ群で163例に認められました。主な重篤な有害事象は、ベクルリー群で呼吸不全39例、心停止10例、敗血症性ショック8例、急性呼吸不全8例、プラセボ群で呼吸不全66例、敗血症性ショック15例、急性呼吸不全14例でした。投与中止に至った有害事象は、ベクルリー群が52例、プラセボ群が70例でした。両群ともに治療と関連ありと判断された死亡は認められませんでした。
- 肝臓、腎臓に関連した有害事象を含む詳細については「5例以上に認められた重篤な有害事象(副次評価項目)」をご参照ください。
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
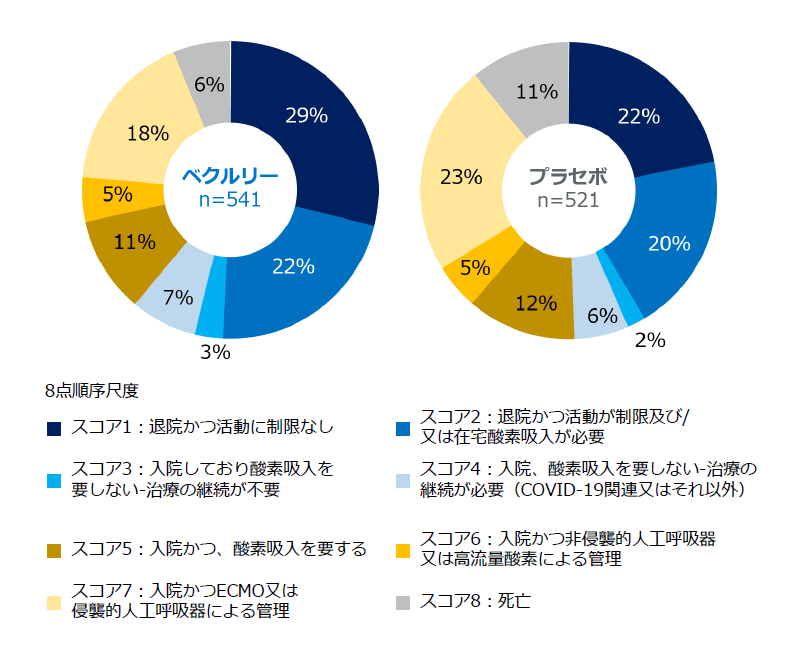
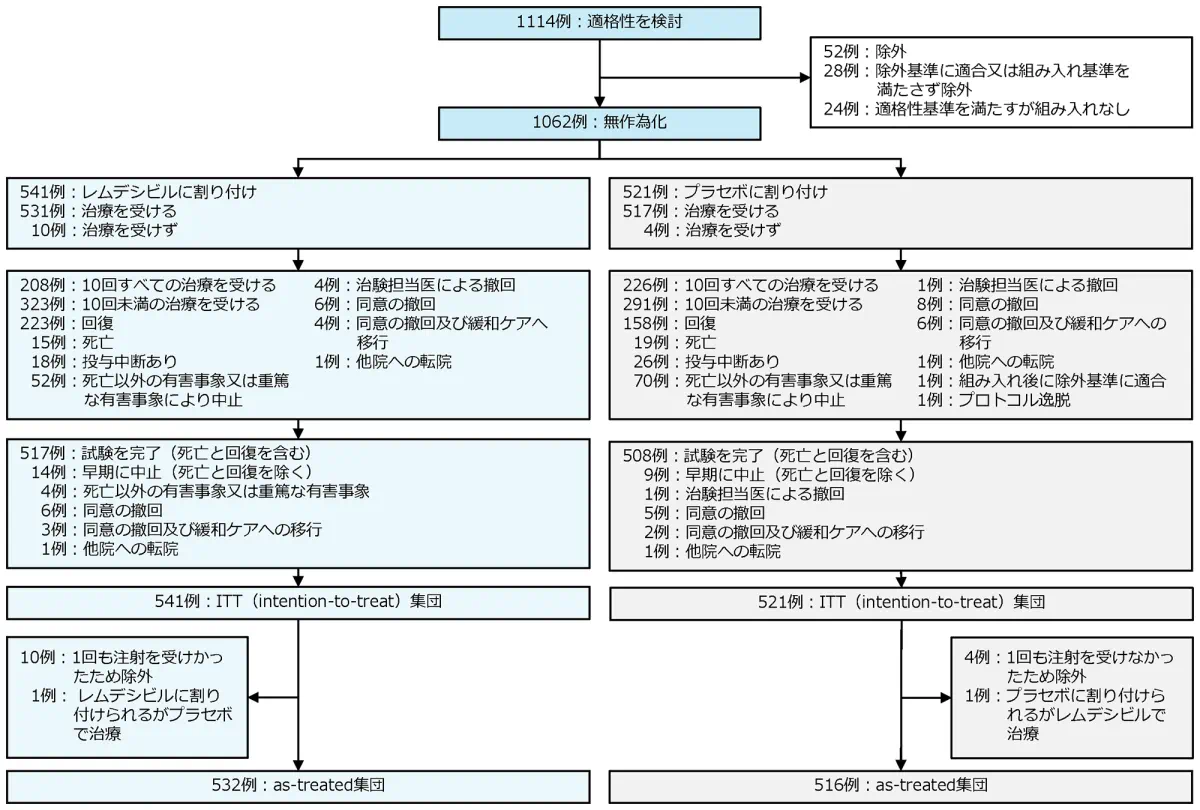
症例構成
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
ベースライン時の人口統計学的及び臨床的特性*
- *:
プラスマイナスの数値は平均値±SD。パーセンテージは端数処理のため合計で100にならない場合がある。IQRは四分位範囲を示す。
- †:
人種及び民族集団は患者からの報告に基づく。
- ‡:
症状発現について3例のデータがなかった。合併症について11例のデータがなく3例のデータが不完全だった。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
累積回復率(主要評価項目)
全体(A)及びベースライン時の順序尺度スコア4(B)、5(C)、6(D)、7(E)の患者のKaplan-Meier法による累積回復率を示す。P値はベースライン時の重症度で層別したlog-rank検定による。
A 全体(検証的な解析結果)
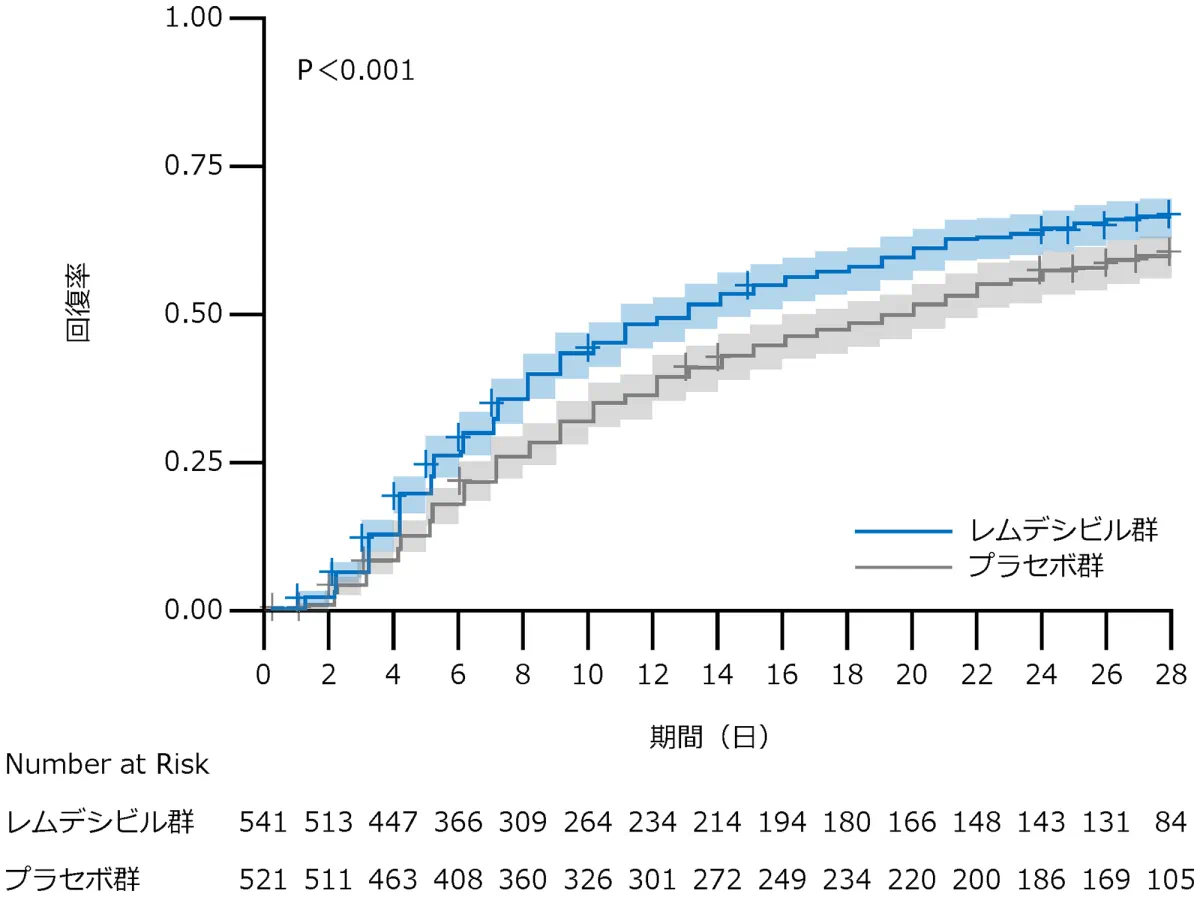
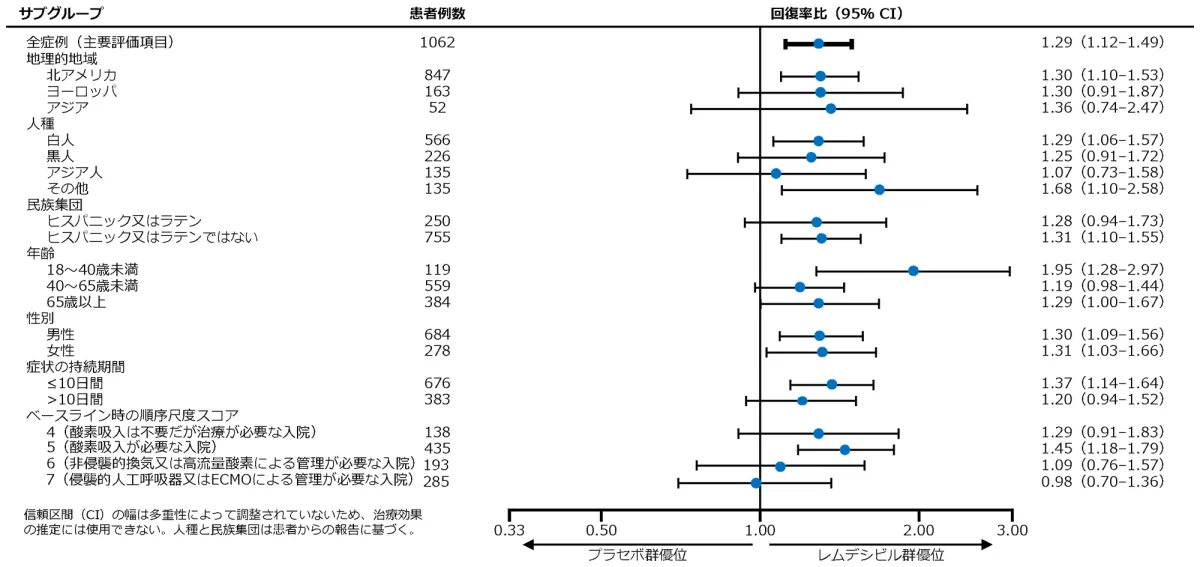
回復した症例はレムデシビル群で399例、プラセボ群で352例、回復までの時間の中央値はレムデシビル群は10日、プラセボ群は15日、回復率比*は1.29(95% CI:1.12-1.48、p<0.001)でした。
B 酸素吸入を必要としていない患者
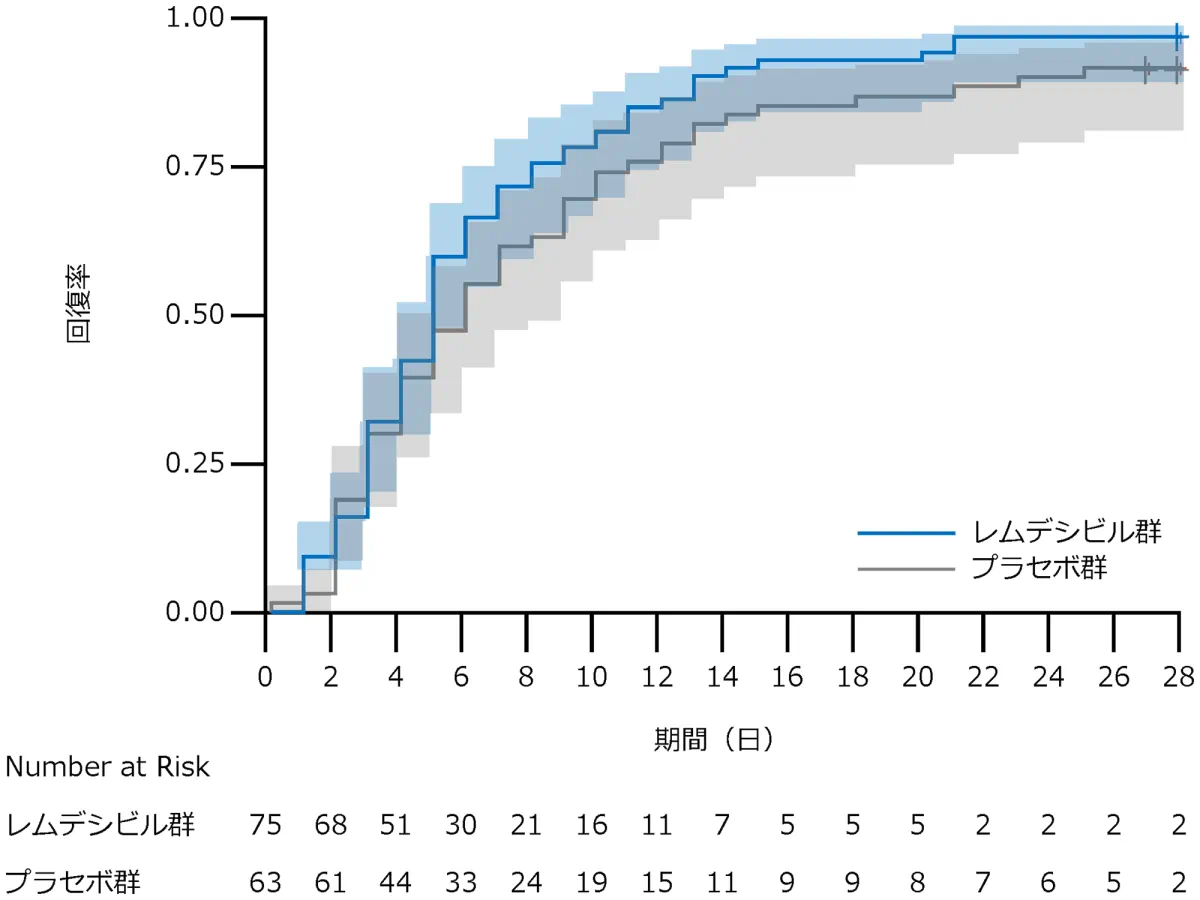
サブグループ解析:回復した症例はレムデシビル群で73例、プラセボ群で58例、回復までの時間の中央値はレムデシビル群は5日、プラセボ群は6日、回復率比*は1.29(95% CI:0.91-1.83)でした。
C 酸素吸入を必要としている患者
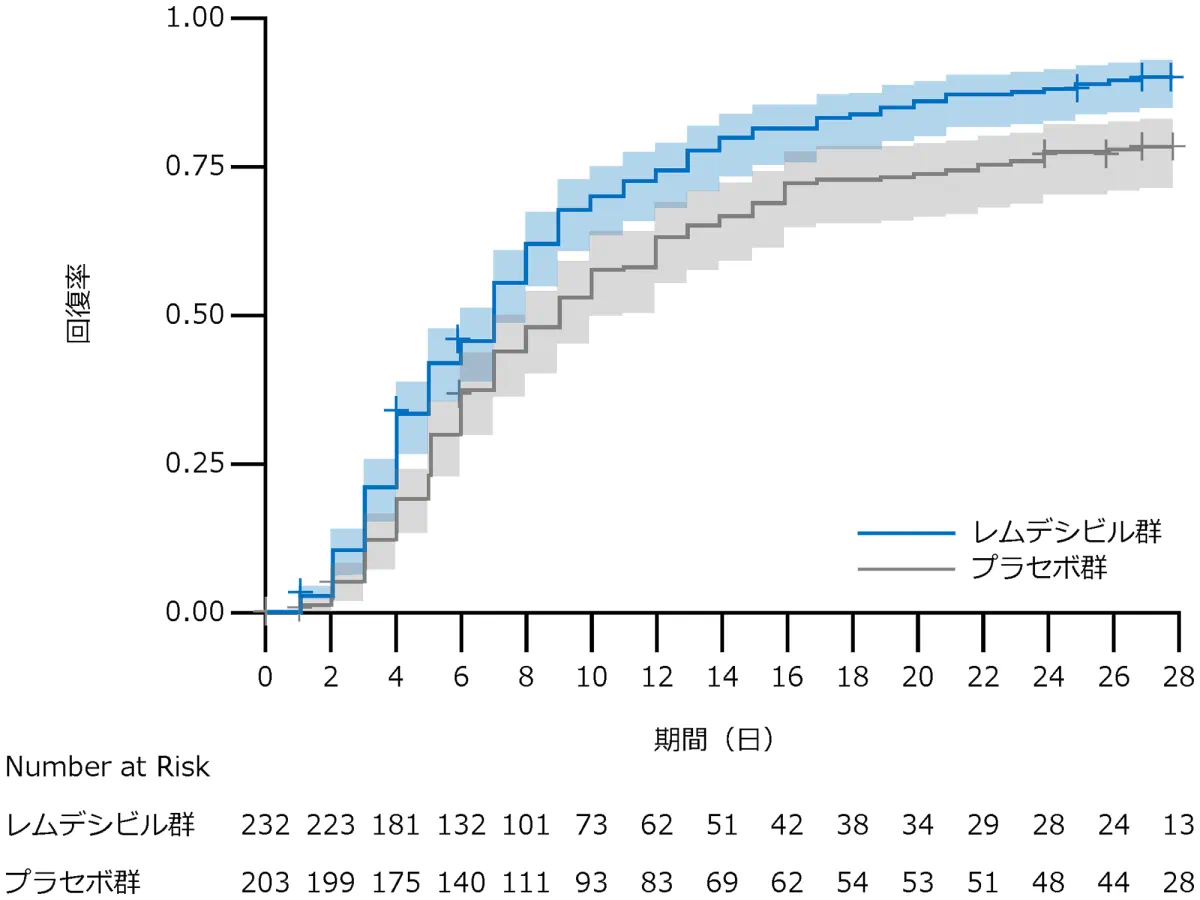
サブグループ解析:回復した症例はレムデシビル群で206例、プラセボ群で156例、回復までの時間の中央値はレムデシビル群は7日、プラセボ群は9日、回復率比*は1.45(95% CI:1.18-1.79)でした。
D 非侵襲的換気又は高流量酸素による管理を必要とする患者
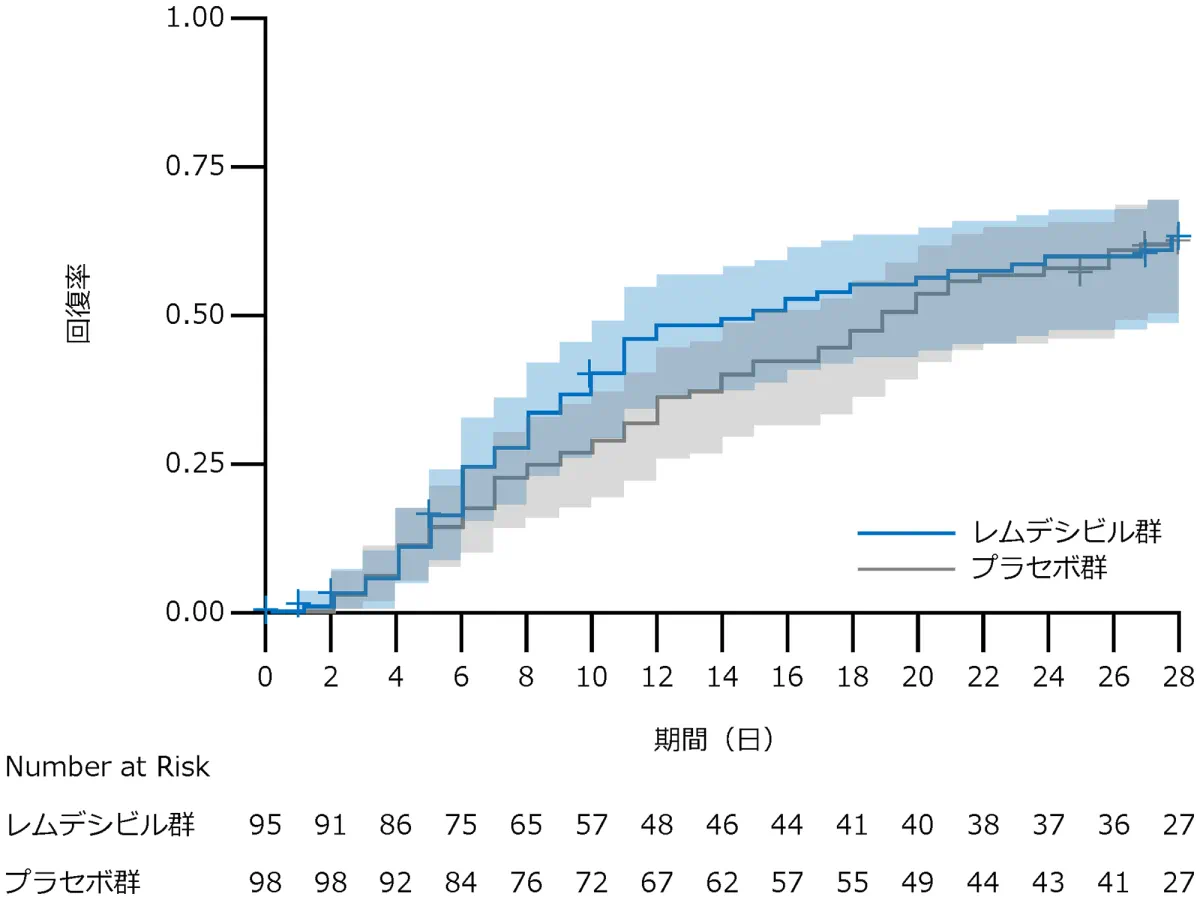
サブグループ解析:回復した症例はレムデシビル群で57例、プラセボ群で61例、回復までの時間の中央値はレムデシビル群は15日、プラセボ群は20日、回復率比*は1.09(95% CI:0.76-1.57)でした。
E 侵襲的人工呼吸器又はECMOによる管理を必要とする患者
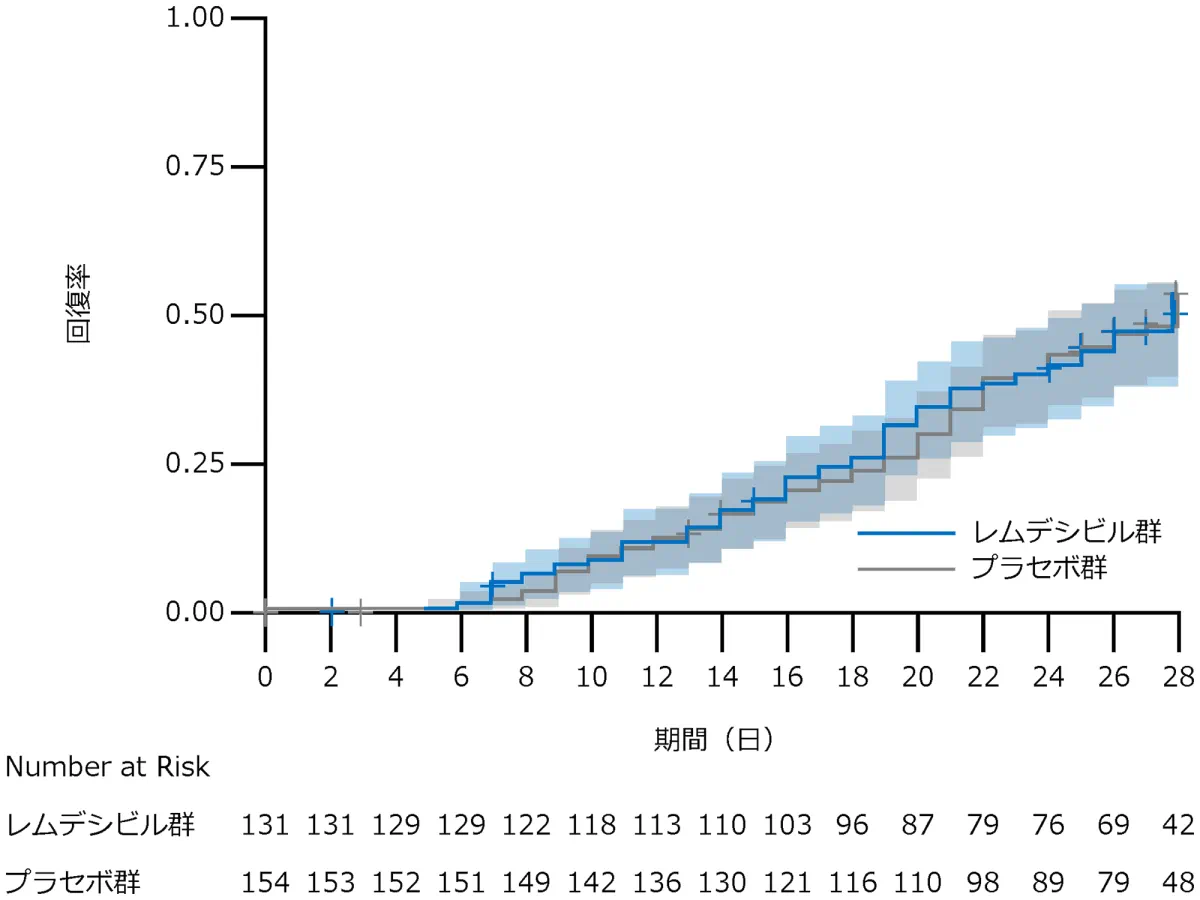
サブグループ解析:回復した症例はレムデシビル群で63例、プラセボ群で77例、回復までの時間の中央値はレムデシビル群は29日、プラセボ群は28日、回復率比*は0.98(95% CI:0.70-1.36)でした。
*回復率比が1より大きい場合は、レムデシビルによるベネフィットを示している。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
死亡率(副次評価項目)

- *:
P値と信頼区間(CI)は多重比較に対して調整していない。「NE」は推定できないことを示す。
- †:
回復率比とハザード比は層別化Coxモデル、P値は層別化log-rank検定で算出した(実際の疾患重症度で層別化した全体モデル)。1を超える回復率比はレムデシビル群が優位であることを示す。ハザード比が1未満の場合レムデシビル群が優位であることを示す。
- ‡:
最初の14日間における死亡率には無作為化後14日間で生存していたすべての患者のデータが含まれ、14日間が最大の追跡時間であることを想定して15日目で打ち切りとされている。試験期間を通じての死亡率は試験データの全体を使用し、無作為化後28日間で生存し追跡期間を完了した患者のデータは打ち切りとした。
- ※:
無作為化当日を含むため無作為化後の日数と異なる。15日目は無作為化後14日目、29日目は無作為化後28日目となる。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with
permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
副次評価項目の結果
レムデシビル群の患者はプラセボ群の患者と比べて、ベースライン時からの順序尺度上で1~2段階改善するまでの期間が短い結果でした(1段階の改善:中央値7日対9日、回復率比1.23、95%CI 1.08~1.41;2段階の改善:中央値11日対14日、回復率比1.29、95%CI 1.12~1.48)。レムデシビル群の患者はプラセボ群の患者と比べて、退院までの期間、または24時間のNational Early Warning Score 2以下になるまでの期間が短い結果でした(中央値8日対12日、ハザード比1.27、95%CI 1.10~1.46)。初回入院期間は、レムデシビル群のほうがプラセボ群より短く(中央値12日対17日)、レムデシビル群の患者の5%が再入院したのに対し、プラセボ群では3%でした。
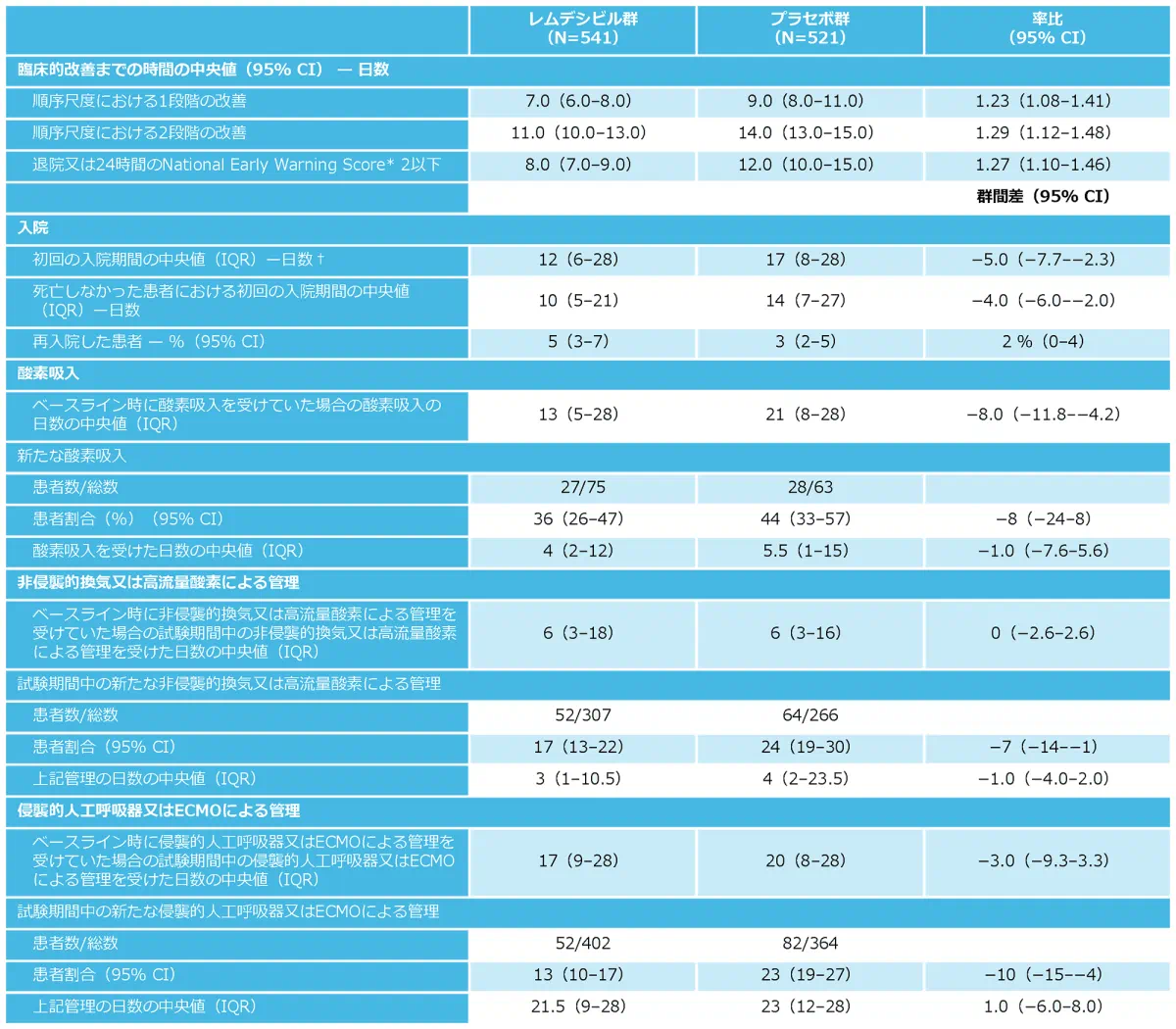
* The National Early Warning Scoreには6つの生理学的測定が含まれる;総計スコアは0~20、スコアが高いほど臨床的リスクが高いことを示す。
†死亡した患者の初回の入院期間は28日とされた。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
サブグループ別の回復までの時間
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
5例以上に認められた重篤な有害事象(副次評価項目)
重篤な有害事象は本剤群で131例、プラセボ群で163例に認められた。主な重篤な有害事象は、本剤群で呼吸不全39例、心停止10例、敗血症性ショック8例、急性呼吸不全8例、プラセボ群で呼吸不全66例、敗血症性ショック15例、急性呼吸不全14例であった。
投与中止に至った有害事象は、ベクルリー群が52例、プラセボ群が70例でした。両群ともに治療と関連ありと判断された死亡は認められませんでした。
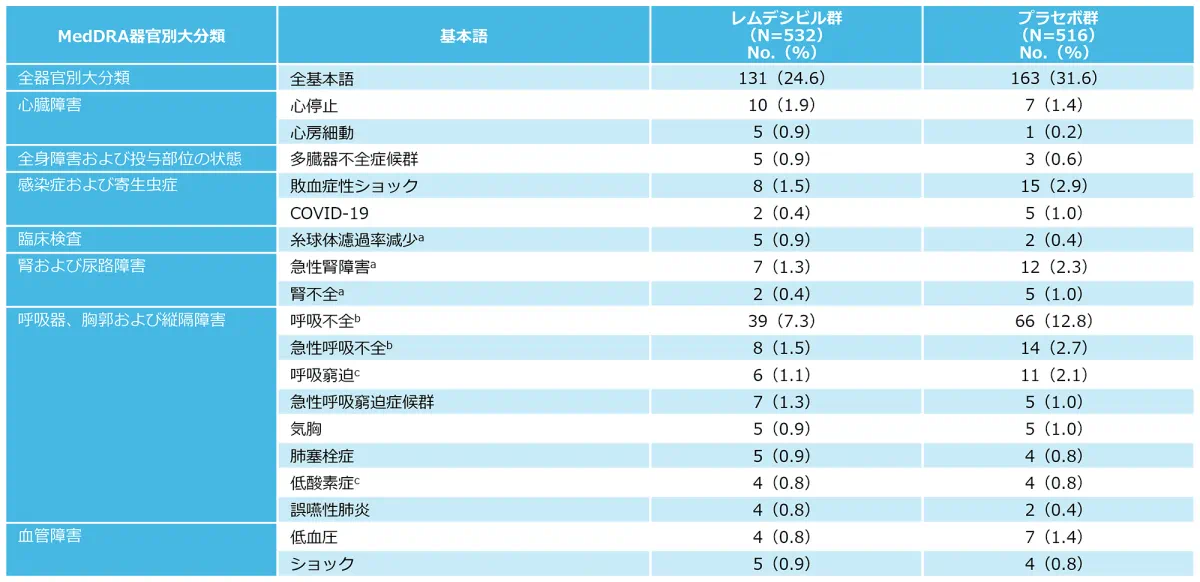
No.:少なくとも1つの事象を報告した患者数。
a 糸球体濾過率減少、急性腎障害又は腎不全が認められた患者の合計は、レムデシビル群で14、プラセボ群で17であった。
b 呼吸不全又は急性呼吸不全が認められた患者の合計は、レムデシビル群で47、プラセボ群で80であった。呼吸器系の重篤な有害事象を伴わない気管内挿管の重篤な有害事象は、呼吸不全に含まれる。
c 低酸素症又は呼吸窮迫が認められた患者の合計は、レムデシビル群で10、プラセボ群で15であった。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
5例以上に認められた重篤ではない有害事象(副次評価項目)
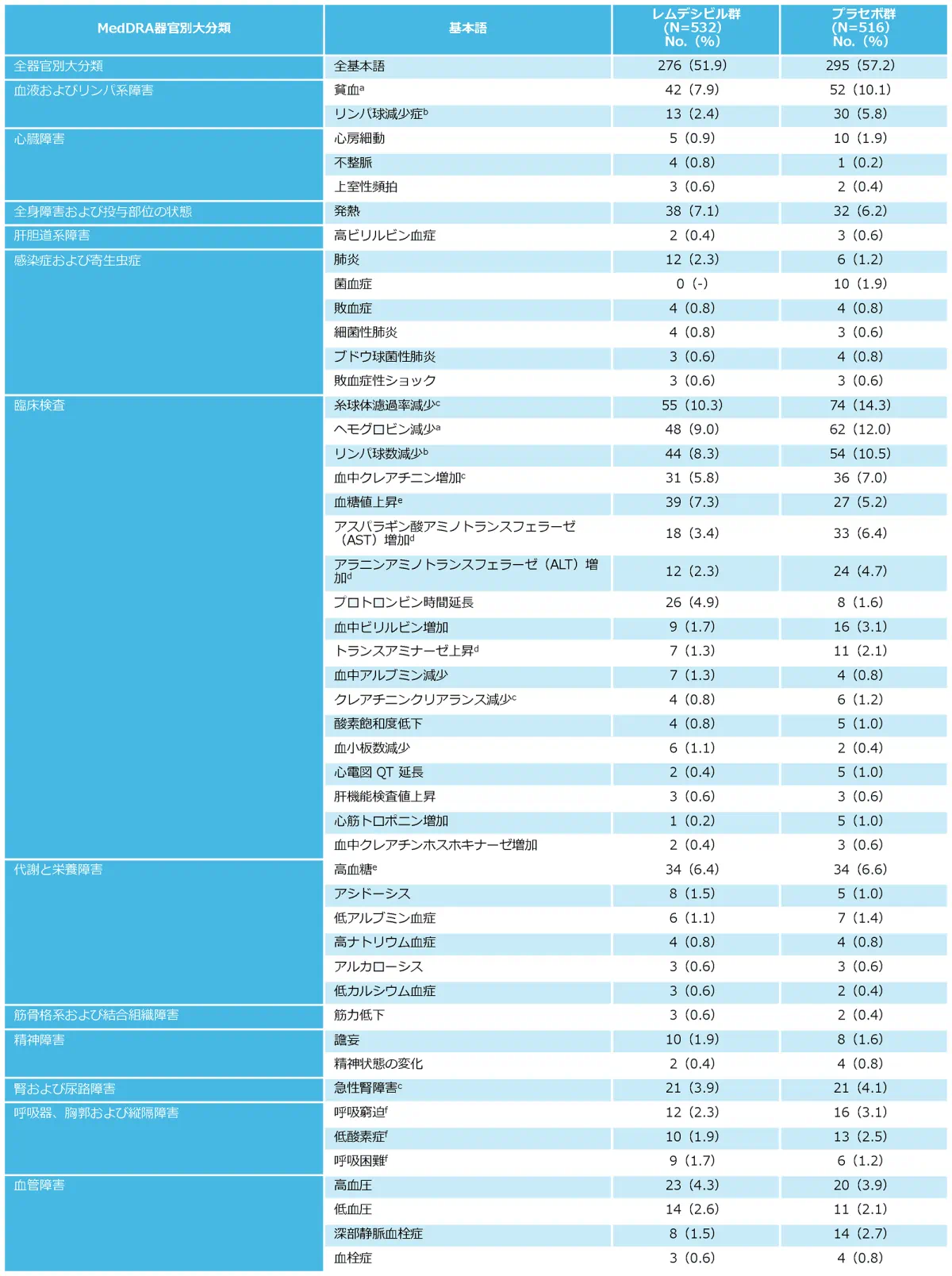
No.:少なくとも1つの事象を報告した患者数。
a 貧血又はヘモグロビン減少が認められた患者の合計は、レムデシビル群で88、プラセボ群で112であった。
b リンパ球減少症又はリンパ球数減少が認められた患者の合計は、レムデシビル群で56、プラセボ群で84であった。
c 糸球体濾過率減少、急性腎障害、血中クレアチニン増加又はクレアチニンクリアランス減少が認められた患者の合計は、レムデシビル群で85、プラセボ群で105であった。
d トランスアミナーゼ上昇、アスパラギン酸アミノトランスフェラーゼ増加又はアラニンアミノトランスフェラーゼ増加が認められた患者の合計は、レムデシビル群で32、プラセボ群で55であった。
e 高血糖又は血糖値上昇が認められた患者の合計は、レムデシビル群で73、プラセボ群で61であった。
f 低酸素症、呼吸困難又は呼吸窮迫が認められた患者の合計はレムデシビル群で30、プラセボで34であった。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Beigel JH et al. N Engl J Med. 2020 ;383(19):1813-1826
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(CO-US-540-5776試験)(承認時評価資料)
なお、これ以上の有害事象に関する詳細な情報は確認できないため、ベクルリー点滴静注用100mgの有害事象については電子添文をご参照ください。


