「禁忌を含む注意事項等情報」等はDIをご参照ください。
GS-US-540-5773(SIMPLE-Severe)試験(国際共同第Ⅲ相試験)
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)
試験概要
| 目的 | SARS-CoV-2による重症感染症患者を対象に、ベクルリー5日間投与と10日間投与の有効性と安全性を検討する。 |
| 試験デザイン | 多施設共同、無作為化、非盲検、並行群間試験 |
| 対象 | 12歳以上18歳未満かつ体重40kg以上、及び18歳以上の重症のSARS-CoV-2による感染症患者397例 |
| 主な選択基準 |
|
| 主な除外基準 |
|
| 試験方法 | 患者を、標準療法に加えて、ベクルリーを初日に200mg、2日目以降は100mgを1日1回、5日目まで静脈内投与する群と10日目まで静脈内投与する群に1:1の割合で無作為に割り付けた。 |
| 主要評価項目 (検証的な解析項目) |
無作為化後13日目に7点順序尺度で評価した臨床状態 |
| 副次評価項目 | 有害事象の発現状況(ベクルリー投与初日~最終投与の30日後) |
| 探索的評価項目 | 臨床的改善までの時間、回復までの時間、部分修正後の回復(time to modified recovery)までの時間、全死亡 |
| 解析計画 |
臨床的改善は、事前に定義した7点順序尺度(スコア1:死亡、2:入院かつECMO又は侵襲的人工呼吸器による管理、3:入院かつ非侵襲的換気又は高流量酸素による管理、4:入院かつ低流量酸素による管理、5:入院しており、酸素吸入を要しないがSARS-CoV-2による感染症にかかわらず継続的な治療を要する、6:入院しており、酸素吸入及び継続的な治療は要しない(ただし、プロトコルに従った本剤の投与は除く)、7:退院)による評価において、ベースライン時から2点以上の改善が得られた場合と定義した。回復は、ベースラインスコア2~5から6又は7への改善と定義した。部分修正後の回復は、ベースラインスコア2~4から5~7への改善、あるいはベースラインスコア5から6又は7への改善として定義した。 主要有効性評価項目については、各レムデシビル群と標準治療群を両側α=0.025(Bonferroni法)で比較した。治療を独立変数として比例オッズモデルを用いてオッズ比及び95%信頼区間を示した。比例オッズの仮定はScore testを用いて検証し、比例オッズの仮定が満たされなかった場合は、Wilcoxon rank sum testによるP値の裏付けを示した。ベースラインの臨床状態を共変量として含めた解析も行った。 |
症例構成
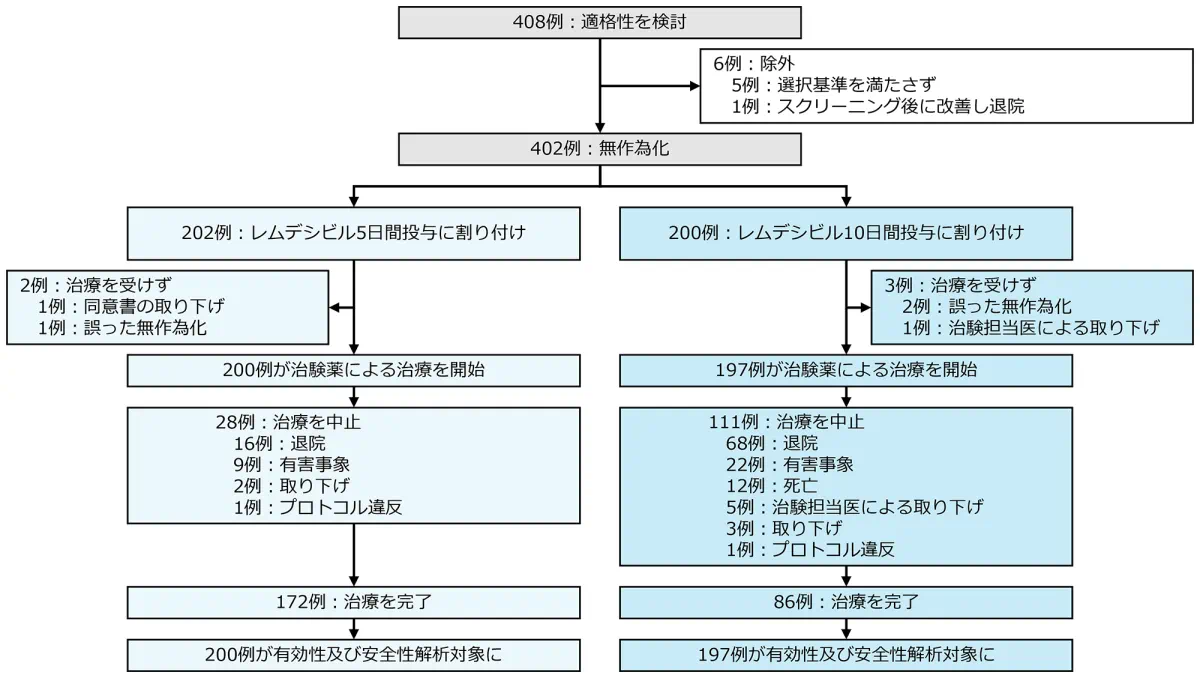
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)
ベースライン時の患者の人口統計学的及び臨床的背景*
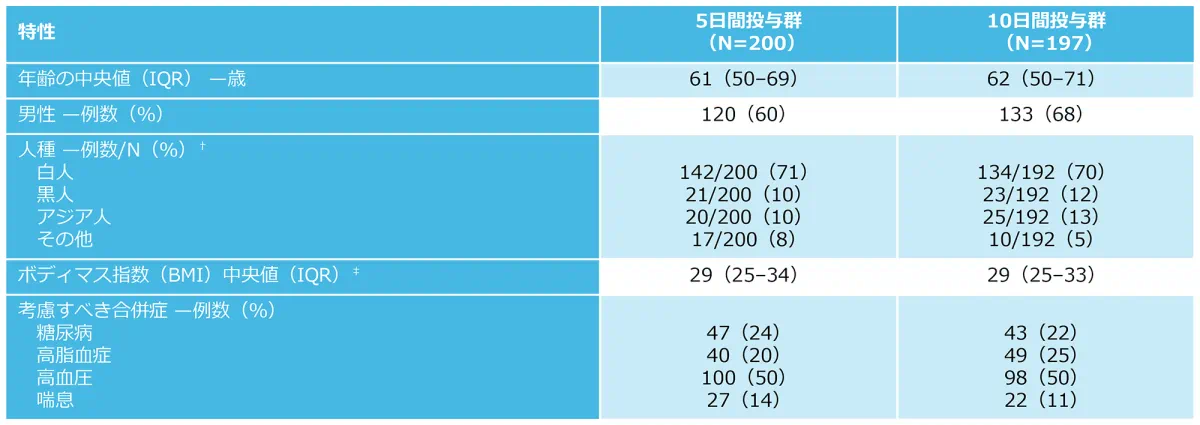
IQR:四分位範囲
*:パーセンテージは端数処理のため合計が100にならない場合がある。
†:人種は患者から報告された。
‡:ボディマス指数(BMI)は、体重(kg)を身長(m)×2で割った値である。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)

ALT:アラニンアミノトランスフェラーゼ、AST:アスパラギン酸アミノトランスフェラーゼ、IQR:四分位範囲
*:パーセンテージは端数処理のため合計が100にならない場合がある。
§:P=0.02 ウィルコクソンの順位和検定による5日投与群と10日投与群の比較。
¶:P=0.008 ウィルコクソンの順位和検定による5日投与群と10日投与群の比較。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)
臨床結果(主要評価項目・探索的評価項目)
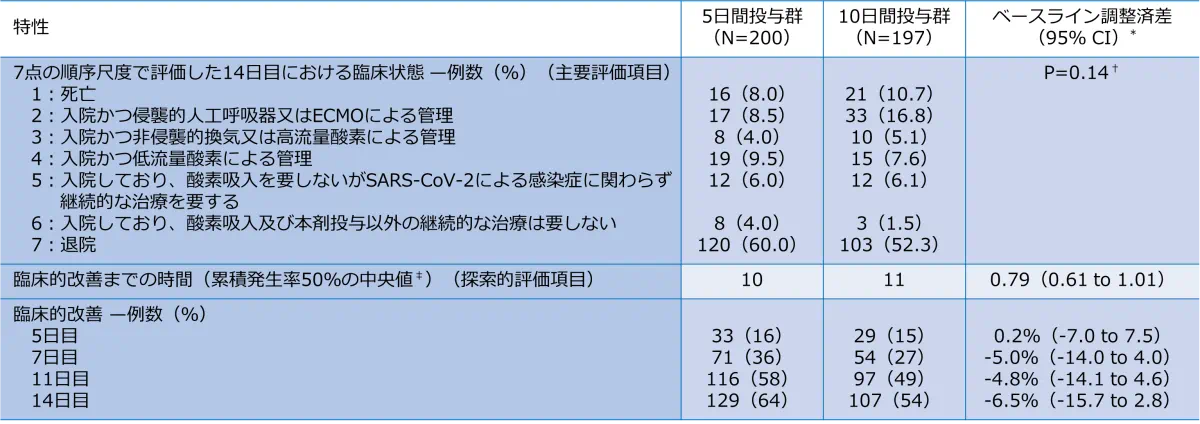
- *:
差異は群間の割合の差を示すが、臨床的改善までの時間、回復までの時間及び部分修正後の回復までの時間については群間差はハザード比及びその95%信頼区間(CI)として示す。イベント発生までのエンドポイントについてのハザード比と95% CIは、治療とベースラインの臨床状態を共変量として含む要因特異的比例ハザードモデルから推定された。事前に規定された時点(例えば、無作為化後4、6、10、13日)でのイベントについては、治療群間で評価中のイベントが発生した被験者の割合の差と95%信頼区間はベースラインの臨床状態によって調整されたMantel-Haenszel割合から推定された。
†:p値はベースラインの臨床状態によって層別化されたWilcoxon rank sum testにより算出された。 - †:
値はベースラインの臨床状態によって層別化されたWilcoxon rank sum testにより算出された。
- ‡:
臨床的改善は、事前に定義した7点順序尺度による評価において、ベースライン時から2点以上の改善が得られた場合と定義した。回復は、ベースラインスコア2~5から6又は7への改善と定義した。部分修正後の回復は、ベースラインスコア2〜4から5〜7への改善、あるいはベースラインスコア5から6又は7への改善として定義した。
累積イベント関数は死亡を競合リスクとして評価対象のイベント(臨床的改善、回復、又は部分修正後回復)までの日数について各群で算出した。最終評価時に評価対象のイベントを達成していない患者データは最後評価時を打ち切りとした。評価対象のイベントを達成する前に死亡した患者は競合イベントを経験したと見なされた。 - ※:
無作為化当日を含むため無作為化後の日数と異なる。5日目は無作為化後4日目、7日目は無作為化後6日目、11日目は無作為化後10日目、14日目は無作為化後13日目となる。
Copyright ©2020 Massachusetts Medical Society. All rights reserved.
Translated with permission.
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)
有害事象の発現状況*(副次評価項目)
有害事象は5日間投与群で70%(141/200例)、10日間投与群で74%(145/197例)に認められた。
重篤な有害事象は5日間投与群で21%(42/200例)、10日間投与群で35%(68/197例)に認められた。
投与中止に至った有害事象は5日間投与群で9例(トランスアミナーゼ増加3件、血小板減少症・肺炎・肝機能検査値上昇・肝酵素増加・血中クレアチニン増加・呼吸不全各1件)10日間投与群で22例(急性腎障害5件、ALT増加3件、高トランスアミナーゼ血症・肝機能検査値上昇・AST増加各2件、貧血・注射部位紅斑・敗血症性ショック・トランスアミナーゼ上昇・肝酵素増加・GFR低下・腎不全・急性呼吸不全・呼吸障害・発疹各1件)に認められた
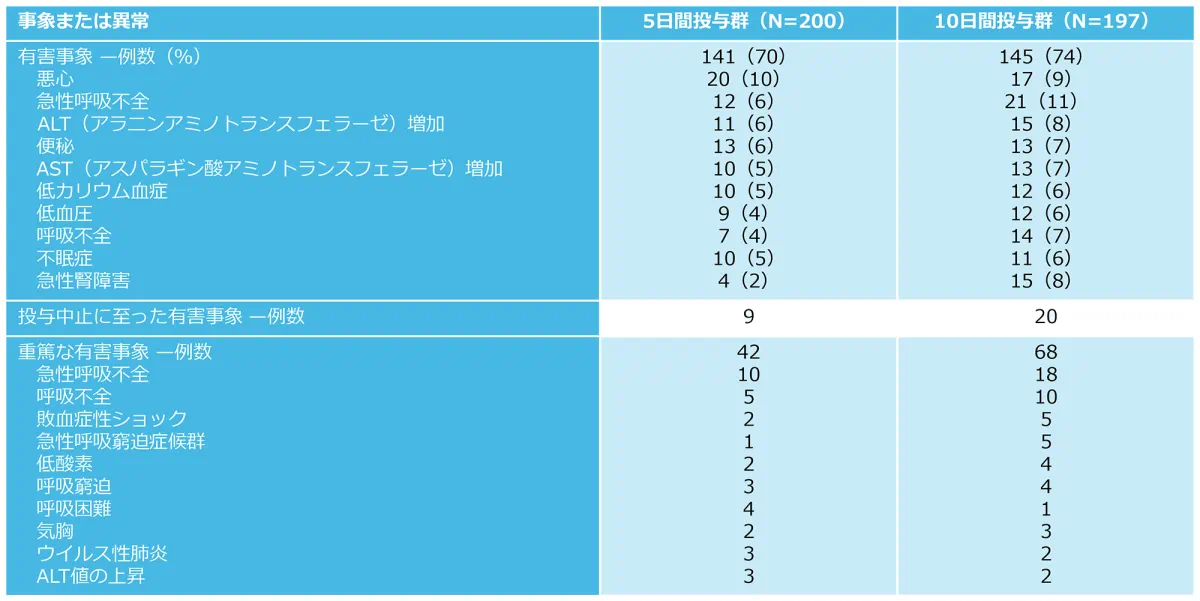
*:記載されている有害事象は、いずれかの治療群患者の少なくとも5%で発生したものであり、記載されている重篤な有害事象は、5例以上の患者で発生したものである。
投与後30日までの全死亡率は5日間投与群が12.5%(25/200例)、10日間投与群で14.2%(28/197例)であった(探索的評価項目)。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)
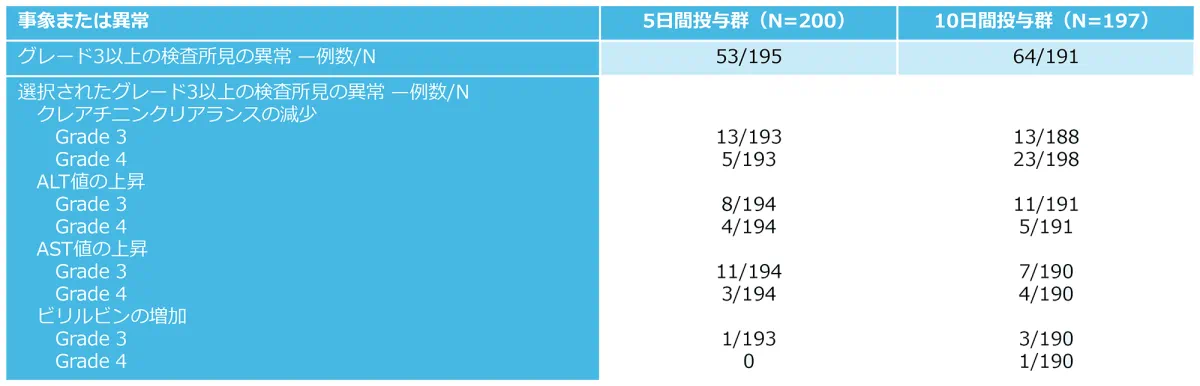
*:記載されている有害事象は、いずれかの治療群患者の少なくとも5%で発生したものであり、記載されている重篤な有害事象は、5例以上の患者で発生したものである。
Copyright ©2020 Massachusetts Medical Society. All rights reserved. Translated with permission.
Goldman JD et al. N Engl J Med. 2020 ;383(19):1827-1837
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
社内資料(GS-US-540-5773試験)(承認時評価資料)
なお、これ以上の有害事象に関する詳細な情報は確認できないため、ベクルリー点滴静注用100mgの有害事象については電子添文をご参照ください。


