厚労省『5学会による新型コロナウイルス感染症 診療の指針2025』におけるベクルリーの位置づけ
ベクルリーの推奨と適用
重症度別マネジメントのまとめ1


重症化に関連する要因と重症度の評価1
COVID-19の重症化に関連する要因としては、『診療の指針』においても『診療の手引き』と同様に年齢、基礎疾患、ワクチン接種歴が挙げられています1。

透析患者における治療と留意点1
『診療の指針』において透析患者に対して用量調節なく使用できる抗ウイルス薬の1つとして、ベクルリーが挙げられています1。

各抗ウイルス薬の特徴1
「腎障害」の項目において、ベクルリーは「添付文書に減量に関する記載なし」と記されています1。
下記の表はベクルリーの適正使用を推進する目的で掲載しています。
他社製品のご使用にあたりましては、電子化された添付文書をご参照ください。

ベクルリー点滴静注用100mg 電子添文 2024年12月改訂(第11版)
7. 用法及び用量に関連する注意(抜粋)
7.2 SARS-CoV-2による感染症の症状が発現してから速やかに投与を開始し、3日目まで投与する。ただし、SARS-CoV-2による肺炎を有する患者では、目安として、5日目まで投与し、症状の改善が認められない場合には10日目まで投与する。
9. 特定の背景を有する患者に関する注意(抜粋)
9.2 腎機能障害患者
添加剤スルホブチルエーテルβ-シクロデキストリンナトリウムの尿細管への蓄積により、腎機能障害が悪化するおそれがある。非臨床試験でレムデシビルに腎尿細管への影響が認められている。[8.3、15.2、16.6.2 参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠ラット及びウサギを用いた胚・胎児への影響に関する試験で、レムデシビル20mg/kgまでを静脈内投与した場合(主要血中代謝物(ヌクレオシド類似体)の全身曝露量(AUC)が国内承認用量投与時曝露量の4倍に相当)、胚・胎児発生に対する影響は認められなかった。雌ラットを用いた受胎能及び初期胚発生への影響に関する試験において、レムデシビル10mg/kgを静脈内投与した場合(主要血中代謝物(ヌクレオシド類似体)の全身曝露量(AUC)が国内承認用量投与時曝露量の1.3倍に相当)、黄体数・胚着床数・生存胚数の減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。レムデシビル及び代謝物であるヌクレオシド類似体(GS-441524)がヒト乳汁中に移行することが報告されている。
治療薬投与開始のタイミング1
これまでもベクルリーの電子添文においては、症状発現から投与開始までに制限は記載されていませんでしたが、『診療の指針』においても「治療薬投与開始のタイミング」の項目にて、「本薬の添付文書では投与開始日についての制限はない」ことが明記されました1。

1. 令和6年度厚生労働行政推進調査事業費補助金 新興・再興感染症及び予防接種政策推進研究事業 新型コロナウイルス感染症診療の指針作成のための研究 5学会による新型コロナウイルス感染症 診療の指針 2025, 2025年9月26日発行.
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00111.html(2025年10月20日閲覧).
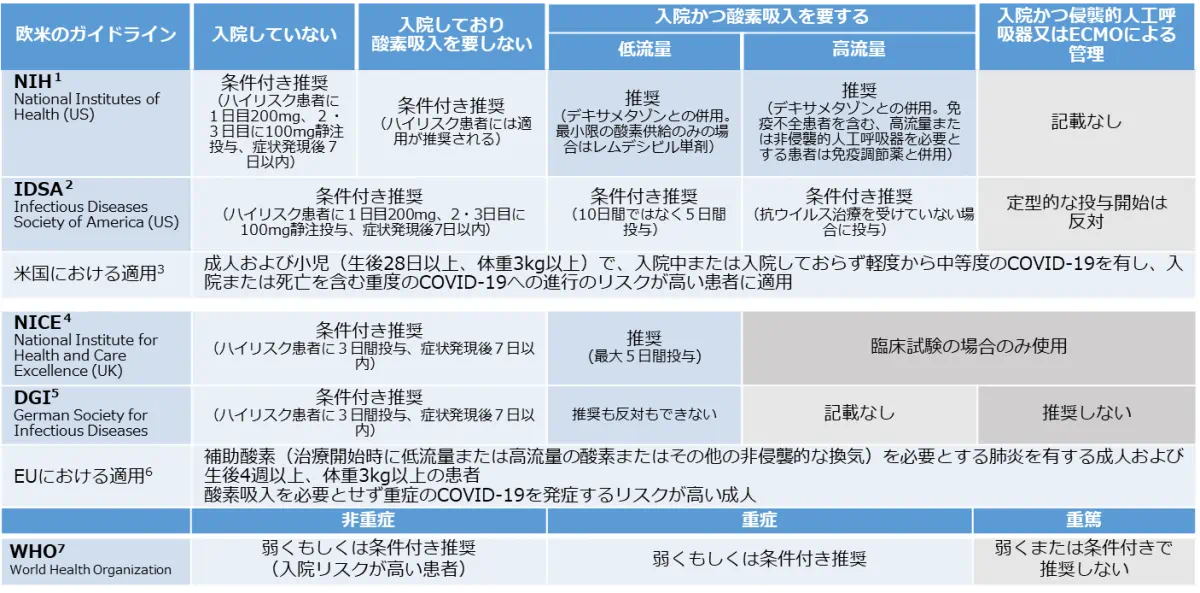
海外のガイドラインにおけるベクルリーの推奨と適用
主なガイドラインにおいてベクルリーは、入院をしていないハイリスク患者~低流量もしくは高流量の酸素吸入を要する患者さんまで一部条件付きで推奨されています。
WHOのガイドラインにおいては非重症では入院リスク程度によって反対となっていますが、重症では「弱くもしくは条件付き推奨」、重篤では「弱くまたは条件付きで推奨しない」となっています。
1. NIH COVID-19 Treatments Guidelines Last Updated:Feb 29, 2024.
https://www.covid19treatmentguidelines.nih.gov/management/clinical-management/clinical-management-summary/(2024年4月9日閲覧、現在閲覧不可)。
2. IDSA Guidelines on the Treatment and Management of Patients with COVID-19 : Last updated: June 26, 2023. https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/(2024年11月7日閲覧)。
3. veklury_pi.https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/214787Orig1s010Lbl.pdf(2024年11月7日閲覧)
4. NICE COVID-19 rapid guideline:managing COVID-19: Last updated: May 8, 2024. https://www.nice.org.uk/guidance/ng191(2024年11月7日閲覧)。
5. S3-Leitlinie - Empfehlungen zur stationären Therapie von Patienten mit COVID-19 - Living Guideline.Last Updated: February 3, 2023. https://www.awmf.org/leitlinien/detail/ll/113-001LG.html(2024年11月7日閲覧).
6. European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/veklury(2024年11月7日閲覧)
7. A living WHO guideline on drugs for covid-19. Last Updated: January 13, 2023. https://www.bmj.com/content/370/bmj.m3379(2024年11月7日閲覧).
NIHの入院患者ガイドラインにおけるベクルリーの推奨
NIHの入院患者を対象としたガイドライン1では、酸素吸入を必要としない入院患者の場合は、重度に進行するリスクの高い患者さんにベクルリーは中程度の推奨とされています。
酸素吸入が必要な場合は、最小限の酸素を必要とする患者にベクルリーが推奨されています。

| 【推奨度の評価】 | A = 強い、B = 中程度、C = 弱い |
|---|---|
| 【エビデンスの評価】 | I = 重大な制限のない1つ以上のランダム化試験、IIa = その他のランダム化試験またはランダム化試験のサブグループ解析、IIb = 非ランダム化試験または観察的コホート研究、III = 専門家の意見 |
1) NIH COVID-19 Treatment Guidelines: Therapeutic Management of Hospitalized Adults With COVID-19. Table 2c. https://www.covid19treatmentguidelines.nih.gov/tables/therapeutic-management-of-hospitalized-adults/ Last Updated: Feb 29, 2024. より改変(2024年4月9日閲覧、現在閲覧不可)
|
a: 危険因子のリストについては、CDCのウェブページ「Underlying Medical Conditions Associated With Higher Risk for Severe COVID-19」(https://www.cdc.gov/coronavirus/2019-ncov/hcp/clinical-care/underlyingconditions.html)を参照してください。 |
|
b: 基礎疾患のために処方されたコルチコステロイドは継続すべき。 |
| c: レムデシビルの有益性は、COVID-19の経過の早期(例えば、症状発現から10日以内)に投与した場合に最大となることを示す証拠2があります。 |
| d: HFNC酸素、NIV、MV、ECMOではない酸素吸入のこと。 |
| e: これらの患者がHFNC酸素、NIV、MV、またはECMOを必要とするようになった場合でも、レムデシビルの全コースを完了する必要があります。 |
| f: 好ましい選択肢または代替療法がいずれも使用できない、または使用が現実的でない場合、JAK阻害薬のトファシチニブ(PO)*(Clla)、IL-6阻害薬のサリルマブ(IV)*を使用できます(Clla)。サリルマブは皮下注射薬としてのみ市販されています*。 |
| g: デキサメタゾンは2番目の免疫調節薬が入手できるまで待つことなく、ただちに開始すべきです。他の免疫調節薬が入手できない場合や禁忌の場合は、デキサメタゾンを単独で使用する(AI)。 |
| h:レムデシビルが最も有効な患者の例としては、免疫不全の患者(BⅡb)、ウイルス複製が進行している患者(例:RT-PCRの結果で測定されたCt値が低い患者、または迅速抗原検査の結果が陽性の患者)(BⅢ)、または症状発現から10日以内の患者(CⅡa)が挙げられます。 |
| i: MVまたはECMOを必要とするCOVID-19の入院患者に対するレムデシビルの使用について、パネルが賛成または反対のいずれかを推奨するには十分なエビデンスがない。パネルメンバーの中には、最近MVまたはECMOを開始した患者、免疫不全の患者、ウイルス複製が進行している証拠がある患者、症状発現から10日以内の患者には、免疫調節薬治療にレムデシビルを追加する意見もあります。 |
| j: バリシチニブ(PO)とトシリズマブ(IV)が使用できない、または使用可能でない場合は、バリシチニブ点滴静注の代わりにトファシチニブ(PO)*を使用し(CⅡa)、トシリズマブ(IV)*の代わりにサリルマブ点滴静注を使用することができます(CⅡa)。 |
| *:トファシチニブ、サリルマブは本邦においては適応外 |
| CDC = 疾病予防管理センター、ECMO =体外式膜型人工肺、ER = 緊急治療センター、HFNC =高流量鼻カニュラ酸素療法 、Hgb = ヘモグロビン、ICU = 集中治療室、IL = インターロイキン、 IV = 点滴静脈注射、JAK = ヤヌスキナーゼ、mAb = モノクローナル抗体、MV = 機械的換気、NIV = 非侵襲的換気、The Panel = COVID-19 治療ガイドラインパネル、PO = 経口投与、ULN = 正常上限値 |
1. NIH COVID-19 Treatment Guidelines: Therapeutic Management of Hospitalized Adults With COVID-19. https://www.covid19treatmentguidelines.nih.gov/tables/therapeutic-management-of-hospitalized-adults/
Last Updated: Feb 29, 2024. より改変(2024年4月9日閲覧、現在閲覧不可)
2. Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けている。本論文の著者の一部はギリアド・サイエンシズ社の社員である。
NIHの非入院患者(酸素吸入を必要としない軽症から中等症患者)のガイドライン1において、レムデシビルは重度COVID-19に進行するリスクが高い患者b,cに推奨されています

- a:
現在、COVID-19の外来患者におけるデキサメタゾンの使用に関する安全性と有効性のデータは不足しています。COVID-19の外来患者に全身性グルココルチコイドを使用することは有害事象を引き起こす可能性があります。
- b:
リスク因子のリストについては、CDCウェブページ(https://www.cdc.gov/coronavirus/2019-ncov/hcp/clinical-care/underlyingconditions.html)にある重度COVID-19の高リスク因子に関連する基礎疾患を参照してください。ワクチン接種を受けた患者に抗ウイルス薬を処方するかどうかを決定する際、臨床医は疾患進行の高リスク因子に注意する。これらの条件には、高齢、直近のワクチン接種からの期間が長いこと(例:6ヵ月より長い)、中等度から重度の免疫不全状態や免疫抑制薬の服用によりワクチン接種に対する十分な免疫応答が得られる可能性が低下していることなどが含まれます。リスク因子の数や重症度もリスクの程度に影響します。
- c:
免疫不全で、COVID-19の症状が長引き、ウイルス複製が継続している証拠がある患者に対する可能性のある治療法があります。
- d:
ウイルスのリバウンドや症状の再発に関する懸念は、抗ウイルス療法の使用が必要な場合にその使用を避ける理由にはなりません。詳細については、以下の「ウイルスのリバウンドと症状の再発」を参照してください。
- e:
治療開始後、患者が入院を必要とする場合、医療従事者の判断で全治療コースを終了することができます。
- f:
ニルマトレルビル/リトナビルには重大な薬物間相互作用がある。臨床医は患者の併用薬を注意深く確認し、潜在的な薬物間相互作用を評価すべきです。
- g:
レムデシビルの投与には、1日1回の点滴静注が3日間必要です。
- h:
モルヌピラビルは、パネルが推奨した他の選択肢よりも有効性が低いと思われます。
- i:
パネルは、他に選択肢がなく、治療法が明確に示されない限り、妊娠中のCOVID-19の治療にモルヌピラビルを使用しないことを推奨しています(AⅢ)。
CDC = 疾病予防管理センター、 IV = 点滴静脈注射、The Panel = COVID-19 治療ガイドラインパネル
【推奨度の評価】A = 強い、B = 中程度、C = 弱い
【エビデンスの評価】I = 重大な制限のない1つ以上のランダム化試験、IIa = その他のランダム化試験またはランダム化試験のサブグループ解析、IIb = 非ランダム化試験または観察的コホート研究、III = 専門家の意見
1. NIH COVID-19 Treatment Guidelines: Therapeutic Management of Nonhospitalized Adults With COVID-19. Table 2a. https://www.covid19treatmentguidelines.nih.gov/tables/therapeutic-management-of-nonhospitalized-adults/ Last Updated: Feb 29, 2024.改変(2024年4月9日閲覧、現在閲覧不可)


