「禁忌を含む注意事項等情報」等はDIをご参照ください。
GS-US-540-9012(PINETREE)試験(海外第Ⅲ相試験) (海外データ)
第Ⅲ相臨床試験(電子添文改訂時評価資料)
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
試験概要
| 目的 | 本試験ではCOVID-19新規患者の急増とそれに伴う医療機関の逼迫を解消するために、外来におけるベクルリー投与の有効性と安全性を検討する。 |
| 試験デザイン | 多施設共同、無作為化、二重盲検、並行群間試験 |
| 対象 |
COVID-19の進行リスクが高い12歳以上、もしくは60歳以上の患者で、症状発現から7日以内かつ陽性が判明して4日以内の1264名(試験途中で患者登録が中止されたため、無作為化されたのは584名*)を対象とした。
|
| 主な選択基準 |
|
| 主な除外基準 |
|
| 試験方法 | プラセボ対照無作為化二重盲検並行群間比較試験。患者を無作為化し、ベクルリーを点滴静注で初日に200mg投与、2日目と3日目に100mg投与する群とプラセボ群に1:1の比率で割り付けた。 |
| 主要評価項目 (検証的な解析項目) |
28日目までのCOVID-19関連の入院又は全死亡、投与下で発現した有害事象の割合。 |
| 副次評価項目 | 28日目までのCOVID-19関連の医療機関受診又は全死亡、28日目までの全死亡率、14日目までにFLU-PRO Plus*により報告された症状が緩和するまでの期間、ベースラインから7日目までのSARS-CoV-2の時間加重平均変化量など。
|
| 解析計画 |
主要評価項目及び副次評価項目に関するハザード比、レート比、両側95%信頼区間(CI)を、療養施設への入居状況(有又は無)、年齢(60歳未満又は60歳以上)、居住地域(米国又は米国外)の層別因子で調整したCox比例ハザードモデルで算出した。有効性の主要評価項目に対するP値は、同じ方法を用いて算出した。28日目までにCOVID-19関連で入院した患者の割合は、Kaplan-Meier解析により算出された。ベースラインから7日目までのウイルス量の時間加重平均変化は、ベースラインのウイルス量を共変量とした共分散分析で評価した。 算出されたすべての信頼区間の幅は、多重性の調整を行わなかった。主要評価項目について、居住地域、年齢、介護施設入所、性別、人種、重症化リスク、ベースライン時のCOVID-19の症状によるサブグループ解析を行った。 |
試験のサマリー
- レムデシビルの3日間投与は、進行リスクの高い軽症のCOVID-19患者に対して、プラセボ群と比較してCOVID-19関連の入院または全死亡のリスクを下げることが示されました(主要評価項目、検証的解析結果)。
投与下で発現した有害事象はレムデシビル群が118例 (42.3%)、プラセボ群が131例(46.3%)、投与中止に至った有害事象はレムデシビル群が2例 (0.7%)、プラセボ群が5例(1.8%)でした(主要評価項目、検証的解析結果)。
- 試験デザイン
・ GS-US-540-9012(PINETREE)試験は進行リスクの高い軽症のCOVID-19患者1264名(試験途中で患者登録が中止されたため、無作為化されたのは584名)を対象としたプラセボ対照無作為化二重盲検並行群間比較試験です。
- 28日目までのCOVID-19関連の入院または全死亡(主要評価項目)
・28日目までのCOVID-19関連の入院または全死亡のリスクはプラセボ群と比較して87%低下しました(HR 0.13, 95% CI:0.03–0.59, p=0.008、Cox比例ハザードモデル、検証的解析結果)。
- 投与下で発現した有害事象の割合(主要評価項目)
・投与下で発現した有害事象はレムデシビル群が118例 (42.3%)、プラセボ群が131例(46.3%)、投与中止に至った有害事象はレムデシビル群が2例 (0.7%)、プラセボ群が5例(1.8%)でした。
- 28日目までのCOVID-19関連の医療機関受診または全死亡(副次評価項目)
・28日目までのCOVID-19関連の医療機関受診または全死亡のリスクはプラセボ群と比較して81%低下しました(HR 0.19, 95%CI:0.07–0.56, Cox比例ハザードモデル)。
- 症状が緩和するまでの期間(副次評価項目)
・初回投与前にFLU-PRO Plus*の質問に回答した126名のうち、14日目までに症状の緩和が認められたのは、レムデシビル群66名中23名(34.8%)とプラセボ群60名中15名(25.0%)でした(RR 1.41、95% CI:0.73-2.69)。
- ウイルス量の変化(副次評価項目)
・ベースラインから7日目までのウイルス量の時間加重平均変化量について、両群間で大きな差はありませんでした(レムデシビル群-1.24 log10コピー/ml、プラセボ群-1.14 log10コピー/ml、最小二乗平均差0.07、95%CI:-0.10-0.24)。
- バイオマーカーの変化(探索的評価項目)
・各バイオマーカーのベースライン時からの差異をプラセボ群と比較したところ、レムデシビル群はフェリチン(FDR<0.05)、乳酸脱水素酵素(LDH、FDR<0.05)、Dダイマー(FDR<0.05)といったCOVID-19の重症化に関連するバイオマーカーが有意に改善しました。
*FLU-PRO Plus: InFLUenza Patient-Reported Outcome Plus. FLU-PROはウイルス性気道疾患の症状の強度と頻度を測定するために開発されたツールであり、それに味覚と嗅覚の喪失に関する質問が追加されたものがFlu-PRO Plus。

*584名中22名(レムデシビル群13名、プラセボ群9名)が点滴を受けなかったため562名が有効性及び安全性の解析に含まれた。
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
ガイドラインの重症度分類と臨床試験における順序尺度
- 『新型コロナウイルス感染症 COVID-19 診療の手引き』における重症度分類とPINETREE試験における対象患者は下記のとおりです。
- PINETREE試験では、入院していない重症化リスク*の高い患者を対象としています。
*リスク因子:慢性肺疾患、高血圧、心血管疾患、糖尿病、肥満、免疫不全状態、慢性腎臓病、慢性肝疾患、進行がん、鎌状赤血球症

1.令和5年度厚生労働行政推進調査事業費補助金 新興・再興感染症及び予防接種政策推進研究事業 一類感染症等の患者発生時に備えた臨床的対応及び行政との連携体制の構築のための新型コロナウイルス感染症 COVID‐19 診療の手引き 第10.1版. 2024年4月23日発行。 https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00111.html(2024年11月7日閲覧)
2. NIH COVID-19 Treatments Guidelines Last Updated:February 29, 2024. https://www.covid19treatmentguidelines.nih.gov/therapeutic-management/ (2024年4月24日閲覧、現在閲覧不可)
3. Beigel JH, et al.: N Engl J Med 2020; 383: 1813-26.
本論文の著者の一部はギリアド・サイエンシズ社の社員です。
4. Kalil AC, et al.: N Engl J Med 2021; 384(9): 795-807.
本論文の著者の一部はギリアド・サイエンシズ社の社員です。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
5. Spinner CD, et al.: JAMA 2020; 324(11): 1048-1057.
本試験はギリアド・サイエンシズ社より支援を受けています。著者にギリアド・サイエンシズ社より支援を受けている者が含まれます。
6. Goldman JD, et al.: N Engl J Med 2020; 383: 1827-37.
本試験はギリアド・サイエンシズ社より支援を受けています。著者の一部はギリアド・サイエンシズ社の社員です。
7. Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
ベースラインの患者背景
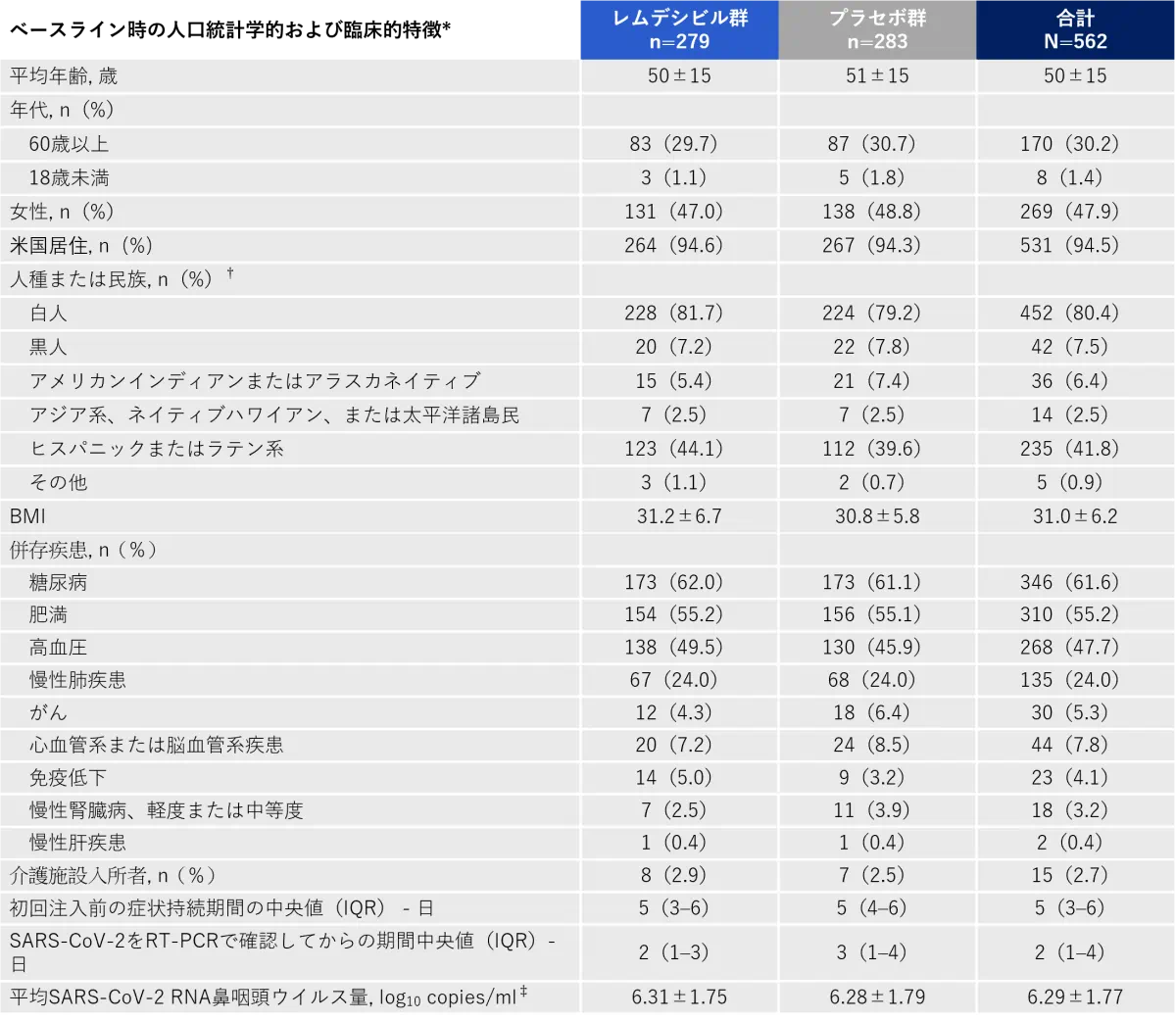
*プラスマイナスの数値は平均値±SD。IQRは四分位範囲、RT-PCRは逆転写酵素-ポリメラーゼ連鎖反応、SARS-CoV-2は重症急性呼吸器症候群コロナウイルス2型を示す。
†人種と民族は患者から報告されたものである。患者は複数の人種または民族を申告できた。
‡データは、統計解析計画書に定義されたウイルス学的解析セットについて示している。レムデシビル群279例中215例(77.1%)、プラセボ群283例中213例(75.3%)。
Copyright © 2021 Massachusetts Medical Society. All rights reserved. Translated with permission.
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
28日目までのCOVID-19関連の入院または全死亡(主要評価項目)
- レムデシビル群において28日目までのCOVID-19関連の入院または全死亡のリスクは、プラセボ群と比較して87%低下しました(HR 0.13, 95% CI:0.03–0.59, p=0.008, Cox比例ハザードモデル、検証的解析結果)。
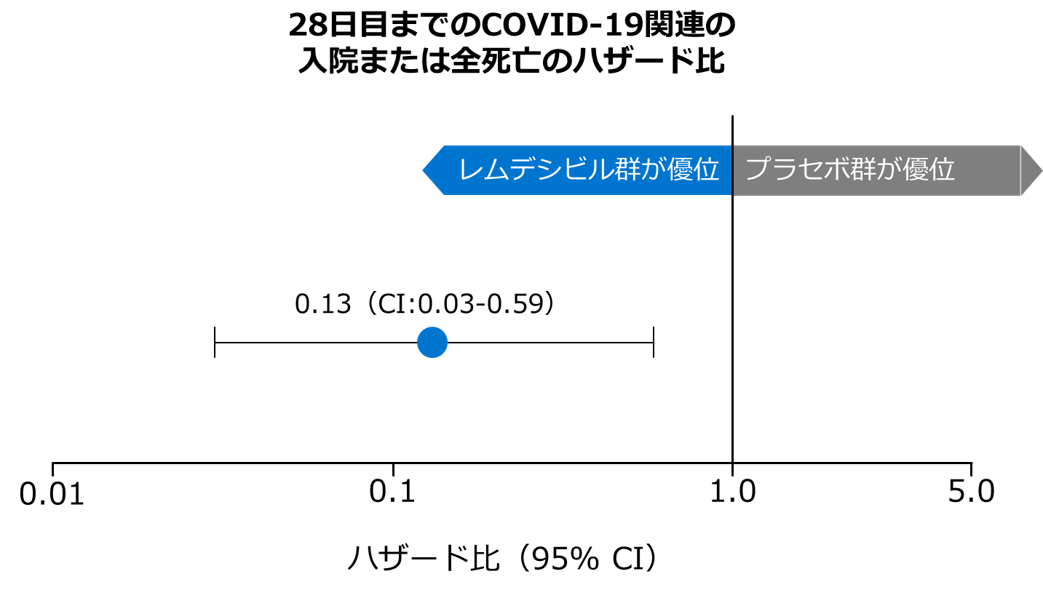
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
投与下で発現した有害事象(主要評価項目)
- 投与下で発現した有害事象はレムデシビル群が118例 (42.3%)、プラセボ群が131例(46.3%)、投与中止に至った有害事象はレムデシビル群が2例 (0.7%)、プラセボ群が5例(1.8%)でした。
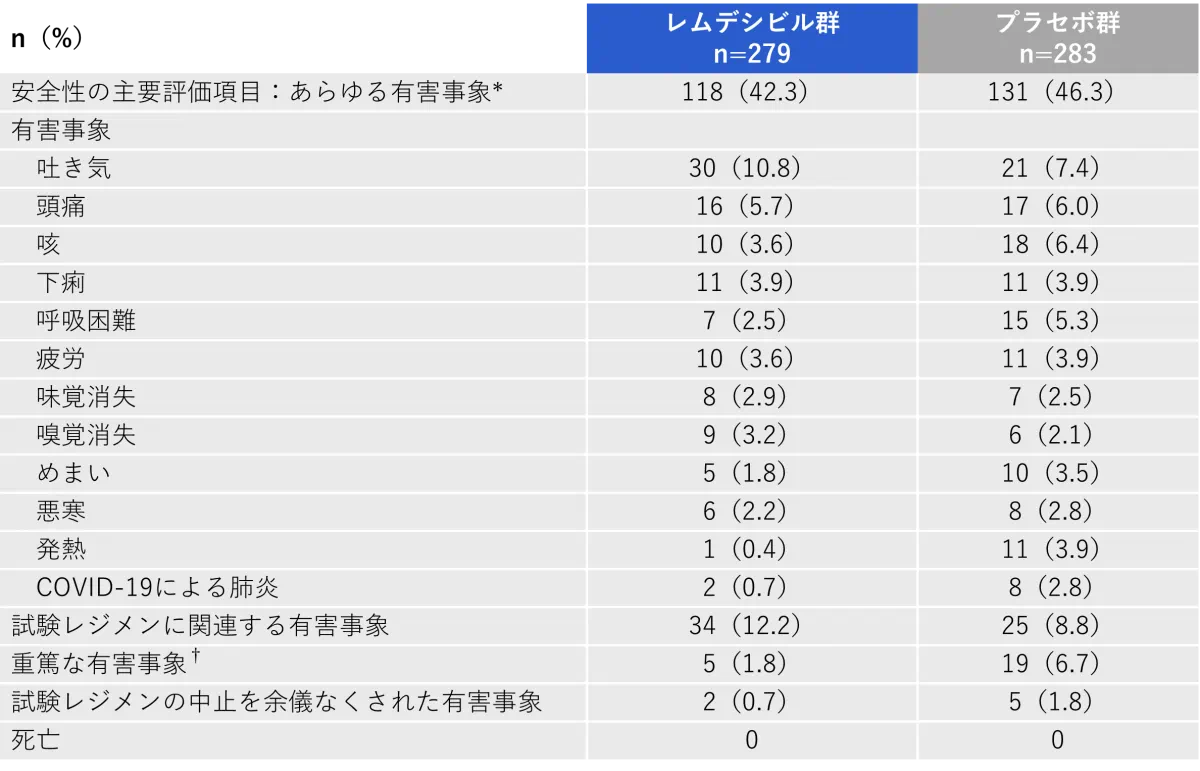
* 青年期患者8名のうち、プラセボ群の1名が有害事象(軽度の疲労感)を報告しました。
†重症度は、Division of AIDS Table for Grading the Severity of Adult and Pediatric Adverse Events, version 2.1に従って定義されました。
Copyright © 2021 Massachusetts Medical Society. All rights reserved. Translated with permission.
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
重篤な有害事象
- 重篤な有害事象はレムデシビル群で5/279例(1.8%)、プラセボ群群で19/283例(6.7%)に認められました。
- 重篤な有害事象はレムデシビル群で肺炎・心房細動各2例、COVID-19・狭心症・呼吸不全・コントロール不良の血圧・うっ血性心不全・ウイルス性心筋炎各1例、プラセボ群でCOVID-19肺炎7例、肺炎・低酸素症各3例、COVID-19 2例、狭心症・呼吸不全・急性心筋梗塞・急性呼吸不全・呼吸困難・フィブリンDダイマー増加・腰椎骨折・僧帽弁逸脱・筋骨格系胸痛・肺塞栓症・交通事故各1例に認められました。

投与中止に至った有害事象
- 投与中止に至った有害事象はレムデシビル群で2/279例(0.7%)、プラセボ群で5/283例(1.8%)に認められました。
- 投与中止に至った有害事象はレムデシビル群でCOVID-19・肺炎・呼吸不全各1例、プラセボ群でCOVID-19肺炎2例、COVID-19・肺炎・低酸素症・呼吸困難各1例に認められました。

28日目までのCOVID-19関連の医療機関受診または全死亡(副次評価項目)
- レムデシビル群において28日目までのCOVID-19関連の医療機関受診または全死亡のリスクは、プラセボ群と比較して81%低下しました(HR 0.19, 95%CI:0.07–0.56, Cox比例ハザードモデル)。
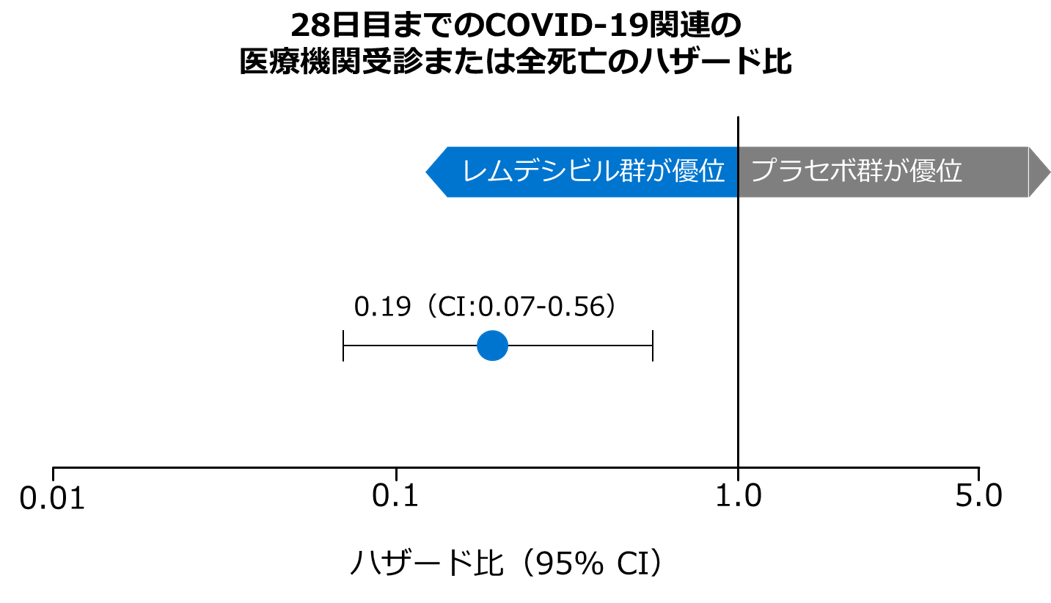
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
試験集団の5%以上で28日目までにCOVID-19に関連した入院またはあらゆる原因による死亡が発生したベースライン時の人口統計学的および臨床的特徴(サブグループ解析)
- 米国に居住、60歳以上、男性、糖尿病、肥満、高血圧の試験集団において、28日目までにCOVID-19関連の入院または全死亡のリスクが、プラセボ群と比較してレムデシビル群のほうが有意に低下しました(Cox比例ハザードモデル)。
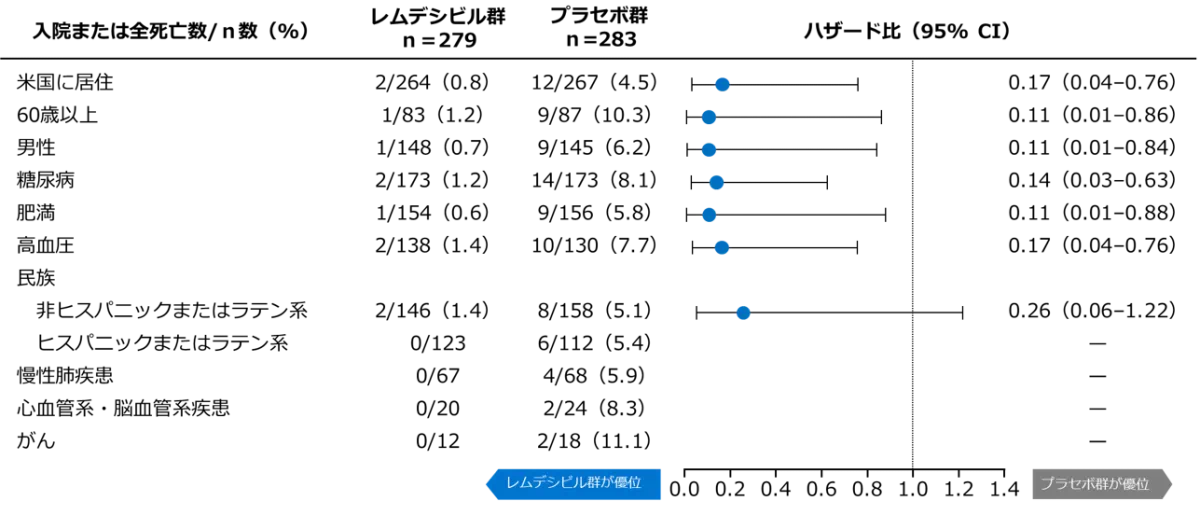
ハザード比および両側95%信頼区間(Iバー)は、ベースラインの層別化因子(介護施設での居住(有または無)、年齢(60歳未満または60歳以上)、国(米国または米国外)を共変量としてCox回帰を使用して推定された。ヒスパニックまたはラテン系の民族グループによる層別化は、ポストホックで実施した。レムデシビル群のイベントがないサブグループのハザード比および95%信頼区間は正確に算出できなかったため、省略した。破線は、ハザード比が1.0であることを示す。
Copyright © 2021 Massachusetts Medical Society. All rights reserved. Translated with permission.
Gottlieb RL, et al: N Engl J Med. 2022; 386(4):305-315. doi: 10.1056/NEJMoa2116846. Epub 2021 Dec 22.
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者の一部はギリアド・サイエンシズ社の社員です。
バイオマーカーの変化(探索的評価項目)
- 各バイオマーカーのベースライン時からの差異をプラセボ群と比較したところ、ベクルリー群は、フェリチン(FDR<0.05)、乳酸脱水素酵素(LDH、FDR<0.05)、Dダイマー(FDR<0.05)といったCOVID-19の重症化に関連するバイオマーカーが有意に改善しました。
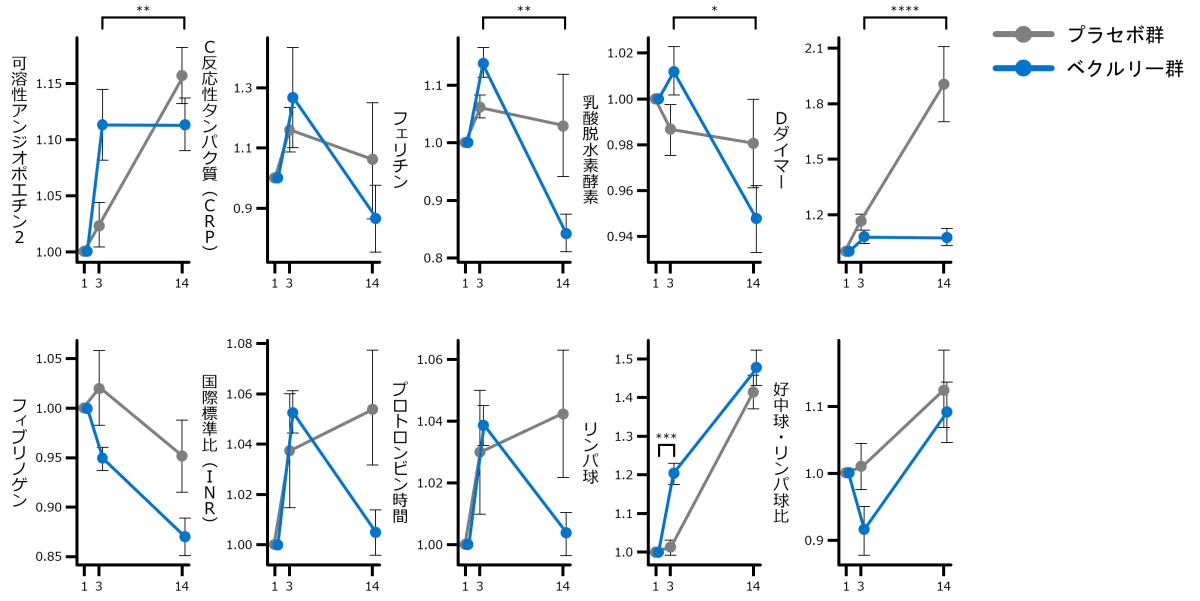
- 目的・対象:
ベクルリーがバイオマーカーに与える影響を検討することを目的に、バイオマーカーの任意評価に同意したPINETREE試験参加者312名を対象とした。
- 方法:
ベースライン時、3日目(治療中)、14日目(治療後)に血清および血漿試料を採取した。ベースライン時(1日目)と治療後の時点(3日目または14日目)の間でバイオマーカー値に有意な変化があったかどうかを判断するために、年齢と性別を固定効果の共変数、患者識別番号をランダム効果として含む線形混合効果モデル(LMM)を使用した。各バイオマーカーはそれぞれ個別のモデルで検証され、特定のバイオマーカーについてデータが欠損している患者はすべて削除された。すべてのp値はBenjamini-Hochberg補正(偽発見率(FDR))を用いて多重検定のために補正された。
Pan DZ, et al.: Commun Med (Lond). 2023 Jan 3;3(1):2. doi: 10.1038/s43856-022-00232-2(https://creativecommons.org/licenses/by/4.0/). より改変。
本試験はギリアド・サイエンシズ社より支援を受けています。本論文の著者はギリアド・サイエンシズ社の社員です。


